题目内容
【题目】向某NaOH溶液中通人CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)(3)(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断一定正确的是(不计CO2的溶解)
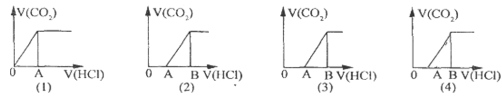
A. (1)图显示M中只有一种溶质且为Na2CO3
B. (3)图显示M中有两种溶质且为Na2CO3、NaOH
C. (2)图显示M中有两种溶质且为Na2CO3、NaHCO3
D. (4)图显示M中c(NaHCO3)=c(Na2CO3)
【答案】C
【解析】
向NaOH溶液中通人CO2气体可能发生的反应有:CO2+2NaOH(过量)=Na2CO3+H2O,CO2+NaOH(少量)=NaHCO3。所得溶液M中的溶质有四种情况:a.NaOH和Na2CO3,b.Na2CO3,c.Na2CO3和NaHCO3,d.NaHCO3。向溶液M中滴入盐酸分别发生反应如下:a.依次发生NaOH+HCl=NaCl+H2O,Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O。滴加盐酸开始没有气体,NaOH反应完全后才产生气体,无气体产生时消耗盐酸的体积大于产生气体时消耗盐酸的体积;b.依次发生Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,开始即产生气体,无气体产生时消耗盐酸的体积等于产生气体时消耗盐酸的体积;c.依次发生Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,第二个反应中的NaHCO3的量既有溶液M中原有的NaHCO3,还包括Na2CO3与盐酸反应生成的NaHCO3,反应开始不产生气体,Na2CO3完全反应后才产生气体,无气体产生时消耗盐酸的体积小于产生气体时消耗盐酸的体积;d. 发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,加入盐酸时即产生气体,直到反应结束。运用数形结合的思想分析解答。
A.(1)图像一开始就产生CO2气体,直到反应结束(拐点表明反应结束),NaHCO3+HCl=NaCl+CO2↑+H2O,溶质只能是一种,应该是NaHCO3,所以(1)图显示M中只有NaHCO3,A项错误;
B.(3)图中OA=AB,滴加盐酸开始时没有气体,这段时间消耗的盐酸体积等于产生气体时消耗盐酸的体积,分析反应Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,可知只能是Na2CO3,所以(3)图显示M中溶质是Na2CO3,B项错误;
C.(2)图中OA<AB,滴加盐酸开始时没有气体,这段时间消耗的盐酸体积小于产生气体时消耗的盐酸的体积,Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,第二个反应中的NaHCO3的量既有溶液M中原有的NaHCO3,还包括Na2CO3与盐酸反应生成的NaHCO3的量,所以(2)图显示溶液M中溶质是Na2CO3和NaHCO3,C项正确;
D.(4)图OA>AB,滴加盐酸开始时没有气体,这段时间消耗的盐酸体积大于产生气体时消耗的盐酸的体积,NaOH+HCl=NaCl+H2O,Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,OA段消耗的盐酸的量包括NaOH消耗盐酸的量和Na2CO3生成NaHCO3消耗盐酸的量,所以(4)图溶液M的溶质是NaOH和Na2CO3,D项错误;答案选C。

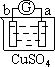
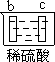
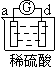
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A a>b>c>d B b>c>d>a C d>a>b>c D a>b>d>c
【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.实验室制备POCl3。采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:

资料:①Ag++SCN-=AgSCN↓:Ksp(AgCl)>Ksp(Ag SCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1) 装置B中的作用是观察氧气的流速和______________、_______________ ,干燥管的作用是_____________
(2)反应温度要控制在60~65℃,原因是:________________________________________________
II.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7 g产品(杂质不含氯元素),置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL 溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 moI/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 moI/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
(3)实验室用5.0 moI/L AgNO3 配制100 mL 3.2 moI/L AgNO3标准溶液,所使用的仪器除烧杯和玻璃棒外还有_____________________
(4)步骤③若不加入硝基苯的将导致测量结果_____(填偏高、偏低或无影响)
(5)步骤④中X可以选择_____。
(6)反应中POCl3的质量百分含量为_____,通过_____(填操作)可以提高产品的纯度。