题目内容
7.铜是与人类关系非常密切的常见金属.已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+═Cu2++Cu.大多数+1价的铜的化合物是难溶物,如Cu2O、CuH等.(1)CuH中H元素的化合价为-1.
(2)目前制备纳米级Cu2O的一种方法:在氢氧化铜悬浊液中滴入N2H4•H2O水溶液,充分反应后即可得到Cu2O,同时产生无色无味的气体.上述制备过程中的总反应的化学方程式为4Cu(OH)2+N2H4•H2O═2Cu2O+N2↑+7H2O.
(3)一定条件下,在CuSO4中加入NH4H反应生成氢化亚铜(CuH).
①CuH在过量稀硫酸中有H2生成,其反应的离子方程式为2CuH+2H+=Cu+Cu2++H2↑.
②将CuH溶解在足量稀硫酸中,当产生6.72L H2(标准状况下)时,参加反应的硫酸的物质的量为0.15mol.
分析 (1)由题意可知,CuH是氢化亚铜;
(2)根据“在新制Cu(OH)2浊液中滴入N2H4•H2O水溶液,同时产生无色无味的气体”判断反应物、生成物,然后写出反应的化学方程式;
(3)①CuH溶解在稀硫酸中,CuH中的H-失电子,硫酸中H+得电子,产生的气体为氢气,酸性溶液中存在2Cu+=Cu2++Cu;
②据CuH与过量稀硫酸反应的离子方程式计算.
解答 解:(1)CuH是氢化亚铜,据化合物中化合价代数和等于0可知,H为-1价,故答案为:-1;
(3)在新制Cu(OH)2浊液中滴入N2H4•H2O水溶液,产生无色无味的气体,根据化合价变化,铜离子化合价降低被还原,能够被氧化生成无色无味的气体可能为N、O元素,由于氧气具有氧化性,不可能生成氧化亚铜,所以该气体只能是氮气,根据化合价升降法配平,反应的化学方程式为:4Cu(OH)2+N2H4•H2O═2Cu2O+N2↑+7H2O,
故答案为:4Cu(OH)2+N2H4•H2O═2Cu2O+N2↑+7H2O;
(3)①CuH溶解在稀硫酸中,CuH中的H-失电子硫酸中H+得电子,产生的气体为氢气,酸性溶液中2Cu+=Cu2++Cu,故离子方程式为:2CuH+2H+=Cu2++Cu+2H2↑
故答案为:2CuH+2H+=Cu+Cu2++H2↑;
②CuH与过量稀硫酸反应的离子方程式为2CuH+2H+=Cu+Cu2++H2↑,生成$\frac{6.72L}{22.4L/mol}$=0.3mol氢气时,参加反应的氢离子物质的量为0.3mol,所以硫酸的物质的量为0.15mol,故答案为:0.15mol.
点评 本题考查了化合价计算、离子方程式书写以及据化学方程式的计算,题目难度不大,注意离子方程式、化学方程式的书写.

练习册系列答案
相关题目
12.铅蓄电池的电极材料是Pb和PbO2,电解液是硫酸溶液.现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是( )
| A. | 电解后,c(Na2SO4)不变,且溶液中有晶体析出 | |
| B. | 电解池的阳极反应式为:4OH--4e-═2H2O+O2↑ | |
| C. | 蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 | |
| D. | 蓄电池中每生成2molH2O,电解池中就消耗1molH2O |
16.下列叙述正确的是( )
| A. | 1 mol H2O的质量为18g | |
| B. | 摩尔是表示物质微粒数目的一个物理量 | |
| C. | 3.01×1023个SO2分子的质量为64g | |
| D. | 标准状况下,1 mol任何物质体积均约为22.4L |
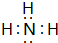 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).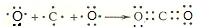 .
.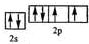 ,该元素的名称是氧.
,该元素的名称是氧. ;元素e的电子排布式为1s22s22p63s23p5,c的离子结构示意图为
;元素e的电子排布式为1s22s22p63s23p5,c的离子结构示意图为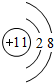
 .
.