题目内容
18.如表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.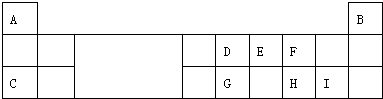
(1)上述元素的单质中金属性最强的是钠(填名称).
(2)D的氢化物与G的氢化物中较稳定的是CH4(填化学式)
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
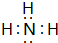 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).(5)已知H2-阴离子的核外电子数与中子数相等,则质量数Z=34;
(6)请用电子式表示化合物DF2的过程
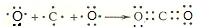 .
.
分析 由元素在周期表中位置,可知A为氢、B为He、C为Na、D为碳、E为氮、F为氧、G为Si、H为硫、I为Cl.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;
(2)非金属性越强,对应氢化物越稳定;
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物为NH3,氨气溶于水后的溶液呈碱性;
(5)S2-阴离子的核外电子数与中子数相等,则中子数为18,质量数=质子数+中子数;
(6)CO2属于共价化合物,用电子式表示形成过程,左侧为原子电子式,右侧为相应物质电子式,中间用→连接.
解答 解:由元素在周期表中位置,可知A为氢、B为He、C为Na、D为碳、E为氮、F为氧、G为Si、H为硫、I为Cl.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中Na的金属性最强,故答案为:钠;
(2)非金属性C>Si,非金属性越强,对应氢化物越稳定,故稳定性CH4>SiH4,故答案为:CH4;
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物为NH3,电子式为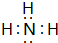 ,氨气溶于水后的溶液呈碱性,故答案为:
,氨气溶于水后的溶液呈碱性,故答案为: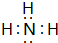 ;碱;
;碱;
(5)S2-阴离子的核外电子数与中子数相等,则中子数为18,则质量数Z=16+18=34,故答案为:34;
(6)CO2属于共价化合物,用电子式表示形成过程为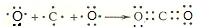 ,
,
故答案为: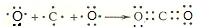 .
.
点评 本题考查元素周期表与元素周期律应用,比较基础,注意理解掌握用电子式表示物质或化学键的形成.

练习册系列答案
相关题目
9.现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).要供选择的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的).
(1)写出制取氮化镁的化学方程式3Mg+N2$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2 .
(2)连接并检查实验装置的气密性,实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填入仪器接口字母编号)
(j)→( )( )→( )( )→( )( )→( )( )→(m)
(3)除装置A、E外,还应选择的装置(填字母代号)及其目的
(4)通气后,先点燃F处酒精灯,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?制得的氮化镁将不纯.
(5)设计实验确定是否有氮化镁生成,写出实验操作、现象.将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁.

(1)写出制取氮化镁的化学方程式3Mg+N2$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2 .
(2)连接并检查实验装置的气密性,实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填入仪器接口字母编号)
(j)→( )( )→( )( )→( )( )→( )( )→(m)
(3)除装置A、E外,还应选择的装置(填字母代号)及其目的
| 装置 | 目的 |
(5)设计实验确定是否有氮化镁生成,写出实验操作、现象.将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁.
3.下列说法错误的是( )
| A. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉就会溶解 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 白纸上滴加浓硫酸后变黑体现了浓硫酸的吸水性 | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实验完成 |


 .
.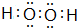 ;试用电子式表示原子个数比为2:1的该化合物的形成过程
;试用电子式表示原子个数比为2:1的该化合物的形成过程 .
.