题目内容
10.用NA代表阿伏加德罗常数的值,下列说法正确的是( )| A. | NA个N2分子与NA个CO分子的质量比为1:1 | |
| B. | 水的摩尔质量等于NA个水分子的相对质量之和 | |
| C. | 在常温常压下11.2LN2含有的分子数为0.5NA | |
| D. | 1mol•L-1NaCl溶液中、含有NA个Na+ |
分析 A、当物质的量相等时,物质的质量之比等于摩尔质量之比;
B、摩尔质量的单位为g/mol;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、溶液体积不明确.
解答 解:A、NA个N2分子与NA个CO分子的物质的量均为1mol,而当物质的量相等时,物质的质量之比等于摩尔质量之比,故两者的质量之比为28:28=1:1,故A正确;
B、摩尔质量的单位为g/mol,故水的摩尔质量只是在数值上和NA个水分子的质量相等,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,分子个数小于0.5NA个,故C错误;
D、溶液体积不明确,故溶液中的钠离子的个数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
20.下列除去杂质(括号内的是杂质)所选用的试剂合理的是( )
| A. | Al (Fe):浓硝酸 | B. | MgO(Al2O3):盐酸 | ||
| C. | FeCl3(FeCl2):氯水 | D. | FeCl2(CuCl2):氢氧化氢钠溶液 |
1.下列各组物质,其分子数相同的是( )
| A. | 1gH2和8g O2 | |
| B. | 1molCO和22.4L水蒸气(一个标准大气压、100℃) | |
| C. | 18g水和标况时22.4L CO2 | |
| D. | 3molSO2和2mol SO3 |
5.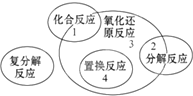 四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )
四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )
 四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )
四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | H2+Cl2 $\frac{\underline{\;点燃\;}}{\;}$ 2HCl | ||
| C. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | D. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
15.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | 碱性锌锰干电池比普通锌锰干电池性能好,比能量和可储存时间均有提高 | |
| B. | 汽车加大油门、把食物放在冰箱里,食品包装袋内放置小包除氧剂,都是为了改变反应物转化率而采取的措施 | |
| C. | 1kg人体脂肪可存储约32 200kJ能量.一般人每行走1km 大约要消耗170kJ 能量,如果每天步行5km,一年(按365天计)中消耗的脂肪大约是9.6kg | |
| D. | 炒菜用铁锅未及时洗净(残液中含NaCl),可能发生电化学腐蚀生成红褐色锈斑 |
2.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)?3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
| A. | 1 mol B和3 mol C | |
| B. | 2 mol A、1mol B和1 mol He(不参加反应) | |
| C. | 1 mol B和1 mol C | |
| D. | 2 mol A、3mol B和3 mol C |
 利用化学反应原理解决下列问题.
利用化学反应原理解决下列问题. △H=+124kJ•mol-1
△H=+124kJ•mol-1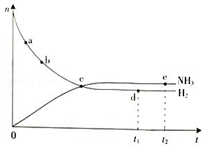 合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题: