题目内容
17.下列叙述正确的是( )| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | Al、Fe、Cu三者的单质放置在空气中均只生成氧化物 | |
| C. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 | |
| D. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
分析 A.氯气具有强氧化性,而HCl具有弱氧化性;
B.Cu在空气中生成铜锈;
C.氧化铝为两性氧化物;
D.非金属性越强,最高价氧化物对应水化物的酸性越强.
解答 解:A.氯气具有强氧化性,而HCl具有弱氧化性,则Fe分别与氯气和稀盐酸反应生成氯化铁、氯化亚铁,故A错误;
B.Cu在空气中生成铜锈(盐类物质),Fe在空气中生成铁锈,Al被氧化生成氧化铝,故B错误;
C.氧化铝为两性氧化物,而氧化铁、氧化亚铁、氧化铜均为碱性氧化物,故C错误;
D.C、P、S、Cl的非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强,故D正确;
故选D.
点评 本题考查物质的化学性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
7.以下说法不正确的是( )
| A. | 由一种元素组成的物质可能是混合物 | |
| B. | 能电离出氢离子的化合物不一定是酸 | |
| C. | 浊液、胶体、溶液的本质区别是分散剂粒子大小 | |
| D. | 电解质与非电解质的分类标准是化合物在水溶液或熔化状态下能否导电 |
5.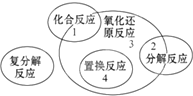 四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )
四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )
 四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )
四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | H2+Cl2 $\frac{\underline{\;点燃\;}}{\;}$ 2HCl | ||
| C. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | D. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
2.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)?3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
| A. | 1 mol B和3 mol C | |
| B. | 2 mol A、1mol B和1 mol He(不参加反应) | |
| C. | 1 mol B和1 mol C | |
| D. | 2 mol A、3mol B和3 mol C |
 一学习小组利用如图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.
一学习小组利用如图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.