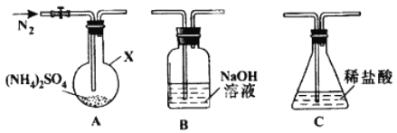
题目内容
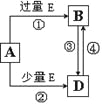
【题目】有机物J的分子式为C10H12O3,是一种重要的化工原料,可用作溶剂、催化剂、塑料助剂以及合成医药、农药等。目前,我国有关 J的用途是作为农药胺硫磷、甲基异柳磷的中间体。下图是这种有机物的合成方案:
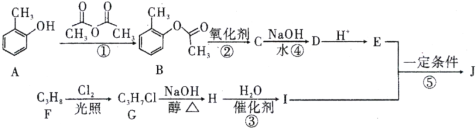
已知:有机物I中有两个化学环境相同的甲基。
请回答下列问题:
(1)写出下列反应的反应类型:①___________,③_____________。
(2)写出反应④的化学方程式:_____________________。
(3)J的结构简式为_____________。
(4)反应①所起的作用是_____________。
(5)H的核磁共振氢谱共有________组吸收峰,其面积之比为____________。
(6)下列有关E的性质说法,正确的是____________。
a.能使酸、碱指示剂变色
b.能使FeCl3溶液显色
c.与纯碱溶液混合无现象
d.难溶于水
e.1ml该有机物与足量钠反应可产生标况下氢气22.4L
(7)满足下列条件且与有机物J互为同分异构体的有机物共有_______种,任写出其中一种的结构简式_______________________________。
A.苯环上仅有两个对位取代基
B.能发生水解反应
C.遇浓溴水能发生反应
【答案】
(1) 取代反应 加成反应
(2)![]() +3NaOH
+3NaOH![]()
![]() +CH3COONa+2H2O
+CH3COONa+2H2O
(3)![]()
(4)保护A中的酚羟基不被氧化
(5)3;3:2:1
(6)abde
(7)7;![]()
【解析】
试题分析:根据题中各物质转化关系,F与氯气发生取代反应生成G,G发生消去反应得H,H与水加成反应得I,I中的两个化学环境相同的甲基,则I应为CH3CHOHCH3,H为CH2═CHCH3,根据比较A和B的结构简式可知,A发生取代反应生成B,B氧化得C为![]() ,C在碱性条件下水解得D为
,C在碱性条件下水解得D为![]() ,D酸化得E为
,D酸化得E为![]() ,E与I发生酯化反应得J为
,E与I发生酯化反应得J为![]() ;
;
(1)根据上面的分析可知,反应①为取代反应,反应③为加成反应;
(2)反应④为![]() 在碱性条件下水解得
在碱性条件下水解得![]() ,反应的化学方程式为
,反应的化学方程式为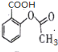 +3NaOH
+3NaOH![]()
![]() +CH3COONa+2H2O;
+CH3COONa+2H2O;
(3)根据上面的分析可知,J的结构简式为:![]() ;
;
(4)比较A和D的结构可知,反应①所起的作用是保护A中的酚羟基不被氧化;
(5)H为CH2═CHCH3,H的核磁共振氢谱共有3个吸收峰,其面积之比为3:2:1;
(6)a.E中含有羧基,能使酸、碱指示剂变色,故a正确;b.E中含有酚羟基,能使FeCl3溶液显色,故b正确;c.E中含有羧基,与纯碱溶液能产生气体,故c错误;d.邻羟基苯甲酸难溶于水,故d正确;e.1ml该有机物与足量钠反应,羧基和羟基都能产生氢气,所以可产生标况下氢气22.4L,故e正确,故选abde;
(7)J为![]() ,根据条件A.苯环上仅有两个对位取代基;B.能发生水解反应,说明有酯基;C.遇浓溴水能发生反应,说明有酚羟基,则符合条件的J的同分异构体为苯环的对位分别连有-OH、-COOCH2CH2CH3,或-OH、-CH2COOCH2CH3,或-OH、-COOCH(CH3)2,或-OH、-CH2CH2COOCH3,或-OH、-CH(CH3)COOCH3,或-OH、-OOCCH2CH2CH3,或-OH、-OOCCH(CH3)2,共有 7种,其中一种的结构简式为,
,根据条件A.苯环上仅有两个对位取代基;B.能发生水解反应,说明有酯基;C.遇浓溴水能发生反应,说明有酚羟基,则符合条件的J的同分异构体为苯环的对位分别连有-OH、-COOCH2CH2CH3,或-OH、-CH2COOCH2CH3,或-OH、-COOCH(CH3)2,或-OH、-CH2CH2COOCH3,或-OH、-CH(CH3)COOCH3,或-OH、-OOCCH2CH2CH3,或-OH、-OOCCH(CH3)2,共有 7种,其中一种的结构简式为,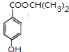 。
。

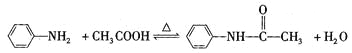
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂和防腐剂、乙酰苯胺的制备原理为
实验参数
名称 | 相对分 | 性状 | 密度(g/mL) | 沸点( | 溶解性 | |
苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
实验装置如图所示(部分仪器及夹持装置已略去)。
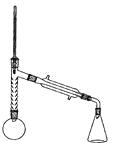
注:①刺型分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。②苯胺易被氧化。
实验步骤:
步骤1:在100mL圆底烧瓶中加入无水苯胺9.3mL、冰醋酸18.4mL、锌粉0.1g和少量沸石,安装好仪器后,对圆底烧瓶均匀加热,使反应液在微沸状态下回流,调节加热温度,使温度计温度控制在105![]() 左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步骤2:在搅拌下,趁热将蒸馏烧瓶中的液体以细流状倒入盛有冰水的100mL烧杯中,快速搅拌,乙酰苯胺结晶析出,烧杯内试剂冷却至室温后,进行抽滤、洗涤、干燥,可得到乙酰苯胺粗品。
步骤3:将乙酰苯胺粗品进行重结晶,待结晶完全后抽滤,尽量压甘干滤饼。将产品置于干净的表面皿中晾干,称重,计算产率、
请回答下列问题:
(1)实验中加入锌粉的目的是_____________________。
(2)从化学平衡的角度分析,控制温度计的温度在105![]() 左右的原因是______________。
左右的原因是______________。
(3)通过_____________可判断反应基本完成、
(4)步骤1加热可用_____________(填“水浴”或“油浴”)。
(5)洗涤乙酰苯胺粗品最合适的方法是__________________(填字母)。
A.用少量冷水洗
B.用少量热水洗
C.先用冷水洗,再用热水洗
D.用酒精洗
(6)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,______________,再将滤液冷却结晶。
(7)该实验最终得到产品9.1g,则乙酰苯胺的产率是____________(小数点后保留两位数字。)
【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 ,该反应为 反应(填“放热”或“吸热”)。
(2)t1=________s, 完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是__________。
(4)t1______(填“>”或“<”)t4,原因是________________________________。
t2________t3(填“>”或“<”),原因是_______________________________。