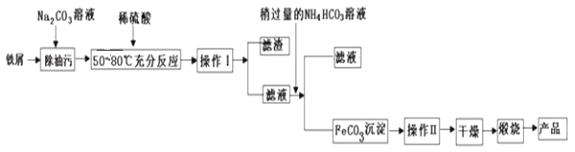
��Ŀ����
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���й�����,ȡ��������Һ20mL������ˮϡ����500mL�������м���m gþǡ����ȫ��Ӧ��
����
����ʽ �� HCl
��Է���������36.5
�ܶȣ�1.2g/cm3
HCl������������36.5��
��1��д��þ�����ᷴӦ�Ļ�ѧ����ʽ _____________________
��2����ϡ�ͺ���������ʵ���Ũ��_______________
��3����m��ֵ________________
��4����Ӧ�����ɵ�H2���Ժͱ�״����_______������O2ǡ����ȫ��Ӧ��
��5����Ӧ����Һ�����ʵ����ʵ���Ũ��Ϊ____________mol��L-1�����跴Ӧ������仯���Ժ��Բ��ƣ�
���𰸡� Mg +2HCl = MgCl2 + H2�� 0.48 mol��L-1 2.88g 1344 0.24
����������1��þ�����ᷴӦ�Ļ�ѧ����ʽΪMg +2HCl = MgCl2 + H2�����ʴ�Ϊ��Mg +2HCl = MgCl2 + H2����
��2������c=![]() Ũ��������ʵ���Ũ��=
Ũ��������ʵ���Ũ��=![]() =12mol/L��ϡ�ͺ���������ʵ���Ũ��=
=12mol/L��ϡ�ͺ���������ʵ���Ũ��=![]() =0.48 mol/L���ʴ�Ϊ��0.48 mol/L��
=0.48 mol/L���ʴ�Ϊ��0.48 mol/L��
��3�����е��Ȼ�������ʵ���Ϊ12mol/L��0.02L=0.24mol������þ�����ʵ���Ϊ0.12mol������m=0.12mol��24g/mol=2.88g���ʴ�Ϊ��2.88g��
��4����Ӧ�����ɵ�H20.12mol������Ҫ���������ʵ���Ϊ0.06mol����״���µ�O2�����Ϊ0.06mol��22.4L/mol=1.344L=1344mL���ʴ�Ϊ��1344��
��5����Ӧ����Һ�������Ȼ�þ�����ʵ���Ϊ0.12mol��Ũ��Ϊ![]() =0.24mol��L-1���ʴ�Ϊ��0.24��
=0.24mol��L-1���ʴ�Ϊ��0.24��