题目内容
【题目】金属铁是般常用的金属之一,其铁合金及其化合物有着重要的用途。
(l)某种铁碳化合物X是炼钢的原料,经分析可知,X中铁、碳两元素的质量比为14:1,则X的化学式________;X在足量的空气中高温煅烧,生成有磁性的固体Y和能使澄消石灰水变浑浊的气体,该反应的化学方程式为___________________。
(2)铁钛合金是一种常用不锈钢材料,某同学在探究该合金性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2Fe3++Fe=3Fe2+ ②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③_______________________。
(3)氧化铁是重要的工业原料,用废铁屑制备它的流程如下:
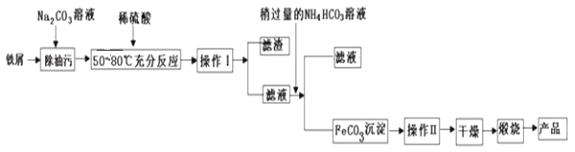
回答下列问题:
①操作Ⅱ的名称是_________。
②请完成生成FeCO3沉淀的离子方程式:_____________;FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5mol/L。试判断所得FeCO3固体是否混有Fe(OH)2:____(填“是”或“否”),请通过简单计算说明理由___________。
(已知Ksp[Fe(OH)2]=4.9×10-17mol3·L-3 、Ksp[FeCO3]=2.1×10-11mol2·L-2)
③煅烧如果不充分,产品中将有Fe2+存在,试设计实验检验产品中有无Fe2+。
_______________________________。
【答案】 Fe3C Fe3C+2O2 ![]() Fe3O4+CO2 2TiO2++Fe+4H+=2Ti3++Fe2++2H2O 洗涤 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 否 c(Fe2+)·c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17,故无Fe(OH)2生成 取样品放入试管中,加入稀硫酸充分溶解得到溶液,滴入K3[Fe(CN)6],若有蓝色沉淀生成,证明含有亚铁离子,否则不存在
Fe3O4+CO2 2TiO2++Fe+4H+=2Ti3++Fe2++2H2O 洗涤 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 否 c(Fe2+)·c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17,故无Fe(OH)2生成 取样品放入试管中,加入稀硫酸充分溶解得到溶液,滴入K3[Fe(CN)6],若有蓝色沉淀生成,证明含有亚铁离子,否则不存在
【解析】(1)X中铁、碳两元素的质量比为14:1,则二者的个数之比是14/56:1/12=3:1,因此X的化学式Fe3C。在足量的空气中高温煅烧生成四氧化三铁和二氧化碳,反应为Fe3C+2O2 ![]() Fe3O4+CO2;(2)根据①②反应以及溶液显紫色可知发生的反应还有2TiO2++Fe+4H+=2Ti3++Fe2++2H2O;(3)①从溶液中得到沉淀需要洗涤,则操作Ⅱ的名称是洗涤。②亚铁离子和碳酸氢根反应生成碳酸亚铁,即生成FeCO3沉淀的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;由于c(Fe2+)·c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2生成;③检验亚铁离子的实验方案是:取样品放入试管中,加入稀硫酸充分溶解得到溶液,滴入K3[Fe(CN)6],若有蓝色沉淀生成,证明含有亚铁离子,否则不存在。
Fe3O4+CO2;(2)根据①②反应以及溶液显紫色可知发生的反应还有2TiO2++Fe+4H+=2Ti3++Fe2++2H2O;(3)①从溶液中得到沉淀需要洗涤,则操作Ⅱ的名称是洗涤。②亚铁离子和碳酸氢根反应生成碳酸亚铁,即生成FeCO3沉淀的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;由于c(Fe2+)·c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2生成;③检验亚铁离子的实验方案是:取样品放入试管中,加入稀硫酸充分溶解得到溶液,滴入K3[Fe(CN)6],若有蓝色沉淀生成,证明含有亚铁离子,否则不存在。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案