题目内容
【题目】[2016新课标Ⅰ]NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
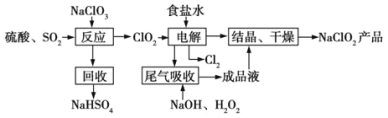
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是____________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为___________,该反应中氧化产物是____________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为__________。(计算结果保留两位小数)
【答案】(1)+3
(2)2NaClO3+SO2+H2SO4![]() 2ClO2+2NaHSO4;
2ClO2+2NaHSO4;
(3)NaOH溶液 Na2CO3溶液 ClO2(或NaClO2);
(4)2∶1 O2
(5)1.57
【解析】(1)在NaClO2中Na为+1价,O为2价,根据正负化合价的代数和为0,可得Cl的化合价为+3。
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,根据得失电子守恒和原子守恒,此反应的化学方程式为2NaClO3+SO2+H2SO4![]() 2ClO2+2NaHSO4。
2ClO2+2NaHSO4。
(3)食盐溶液中混有Mg2+和Ca2+,可利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+;向NaCl溶液中加入ClO2,进行电解,阳极发生反应2Cl2e![]() Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;
Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;
(4)根据图示可知:利用含有过氧化氢的NaOH溶液吸收ClO2气体,产物为NaClO2,则此吸收反应中,氧化剂为ClO2,还原产物为NaClO2,还原剂是H2O2,氧化产物是O2,每1 mol的H2O2转移2 mol电子,反应方程式是:2NaOH+2ClO2+H2O2![]() 2NaClO2+O2+2H2O,可知氧化剂和还原剂的物质的量之比为2∶1,该反应中氧化产物为O2。
2NaClO2+O2+2H2O,可知氧化剂和还原剂的物质的量之比为2∶1,该反应中氧化产物为O2。
(5)每克NaClO2的物质的量n(NaClO2)=1g÷90.5 g/mol=![]() mol,其获得电子的物质的量是n(e)=
mol,其获得电子的物质的量是n(e)=![]() mol×4=4/90.5 mol,1 mol Cl2获得电子的物质的量是2 mol,根据电子转移数目相等,可知其相对于氯气的物质的量为n=
mol×4=4/90.5 mol,1 mol Cl2获得电子的物质的量是2 mol,根据电子转移数目相等,可知其相对于氯气的物质的量为n=![]() mol×4÷2=
mol×4÷2=![]() mol,则氯气的质量为
mol,则氯气的质量为![]() mol×71 g/mol=1.57 g。
mol×71 g/mol=1.57 g。

【题目】(17分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:_____。(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是/span>______,碱性最强的化合物的化学式是:__________。
(3)比较①与⑤的最高价氧化物对应的水化物,_________的酸性强(填化学式);能通过________________________________说明(写反应的化学方程式)。
(4)实验室制取②的氢化物的化学方程式_______________________________ ,②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为______
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________________(用化学方程式表示)
(6)比较③与⑥的氢化物,_________ 更稳定(填化学式)
(7)写出④的单质与水反应的离子方程式_______________________。
(8)写出⑦元素的离子结构示意图______,该离子半径_________ S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置_______________________