��Ŀ����
����Ŀ����Ԫ����һ���ж��ֻ��ϼ۵ķǽ���Ԫ�ء�
��1�������ĵ���56 g����ַ�Ӧ��ת�Ƶĵ�����Ϊ NA����ӦKIO4+8HI![]() 4I2+KI+4H2O���������뻹ԭ�������ʵ���֮��Ϊ ��
4I2+KI+4H2O���������뻹ԭ�������ʵ���֮��Ϊ ��
��2����һ֧�Թ��а�ij˳��������м�������(һ������ֻ��һ��)��
A��KI��Һ B��������Һ C��NaOH��ҺD��ϡH2SO4 E��H2O2��Һ
������Һ��ɫ�����±仯������ɫ�����ػ�ɫ������ɫ������ɫ������ɫ�������ҩƷ��˳����(д���) ����������Ӧ�Ļ�ѧ����ʽΪ ��
��3����ҵ���ƵõĴֵ���ͨ����±�ػ�����ICl��IBr������ʱICl��IBr������I2һ���������ڴֵ��м�������ѡ���е�һ�����ʺ��ٽ����������Ƶþ��⣬Ӧ����������� ��
a.KBr b.KCl c.KI d.Zn
��4����һ�ֵ����������Գ�Ϊ����⣬���е�Ԫ�س�+3��+5���ּ�̬�������ֻ�����Ļ�ѧʽ�� ��
��5��ҽҩ��ҵ����Ҫԭ�ϸߵ����ƿɲ��������������Ʊ�������������ͼ��
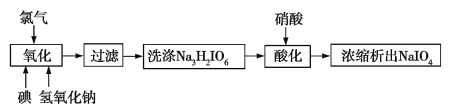
д�����������з�����Ӧ�����ӷ���ʽ�� ��
���𰸡���1��2 1��7
��2��A��E(��E��A)��B��C��D I2+2NaOH![]() NaI+NaIO+H2O
NaI+NaIO+H2O
��3��c
��4��I4O9[��I(IO3)3]
��5��I2+6Na++20OH+7Cl2![]() 2Na3H2IO6��+14Cl+8H2O
2Na3H2IO6��+14Cl+8H2O
��������������Ҫ����⼰�仯��������ʣ����ڿ��鿼���Ի�ѧ֪ʶ������������ ��1������ⷴӦʱֻ����FeI2������������ԭ��Ӧ���ɡ�ֻ��£�����桱��ԭ��֪HI���������ã�����ԭ�����ᡣ
��2��KIΪ��ɫ��Һ(A)������H2O2��Һ(E)��Ӧ���ɵ⣬��Ϊ�ػ�ɫ��Ȼ��ӵ��۱���ɫ(B)���ټ�NaOH��Һ(C)��Ӧ����NaI��NaIO����Һ�ֱ�Ϊ��ɫ������ϡ����(D)������������ԭ��Ӧ���ɵ��ʵ⣬��Һ�л��е��ۣ��ֱ��������Լ���ҩƷ��˳����A��E(��E��A)��B��C��D����������Ӧ�Ļ�ѧ����ʽΪI2+2NaOH![]() NaI+NaIO+H2O��
NaI+NaIO+H2O��
��3�����õ����������Ծ��Ƶ⣬��ʹICl��IBr�е�Cl��BrԪ�ر�Ϊ�ѻӷ��Ե����ʣ�ͬʱʹ����+1�۵ĵⱻ��ԭΪ���ʵ⣬�Ҽ�������ʺ͵ⲻ��Ӧ��ֻ��KI���ϣ���ѧ����ʽΪICl+KI![]() I2+KCl��IBr+KI
I2+KCl��IBr+KI![]() I2+KBr��
I2+KBr��
��4�������ΪIm(IO3)n�����е����Ϊ1���ҵ������IΪ+5�ۣ���ǰ���IΪ+3�ۣ����Ի�ѧʽΪI(IO3)3����I4O9��
��5����������֪����Ӧ����Cl2��NaOH��I2���������г���Na3H2IO6���������������ԭ��Ӧ����֪��Ӧ�õ�NaCl������ԭ���غ�֪����H2O���ɡ�
����ע���Ե⼰�仯����Ϊ���忼�����ʵ����ʡ�������ԭ��Ӧ���ɡ���ѧ����ʽ�����ӷ���ʽ����д��֪ʶ��ǿ��Ԫ�ػ�����֪ʶ�����龳�µ�Ӧ�ã��������ۺ����ڽ������ĸ߿�������ռ�ı���һֱ�ϴ�



