题目内容
【题目】我国科学家成功研制出一种全新的铝—石墨双离子电池(AGDIB)。这种新型AGDIB电池采用廉价且易得的石墨作为电池正极材料,铝锂(AlLi)合金作为负极材料,LiPF6是电解质,碳酸酯为溶剂,反应原理是 AlLi + Cx(PF6)![]() LiPF6 + xC + Al。
LiPF6 + xC + Al。
下列关于该电池的说法不正确的是
A. 该电池不能用水溶液作为电解质
B. 放电时,Li+在电解质中由负极向正极迁移
C. 充电时,若转移1 mol e—,阴极电极将增重7g
D. 放电时,正极的电极反应式为AlLi-e-=Li+ + Al
【答案】D
【解析】A. Li是活泼的金属,能与水反应,因此该电池不能用水溶液作为电解质,A正确;B. 放电时所以原电池,Li+在电解质中由负极向正极迁移,B正确;C. 充电时属于电解池工作原理,电解池的阴极发生得电子的还原反应,即Al+Li++e-=AlLi,所以若转移1 mol e-,阴极电极将增重7g,C正确;D. 放电时,属于原电池的工作原理,正极CxPF6得电子被还原,电极反应式为CxPF6+e-=xC+PF6-,D错误,答案选D。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】下列陈述I、II正确并且有因果关系的是 ( )
选项 | 陈述I | 陈述II |
A | 铝可以分别和NaOH溶液、盐酸反应 | 铝既有金属性又有非金属性 |
B | Na2CO3可以制胃药 | Na2CO3可以和盐酸反应 |
C | 硬铝是合金 | 其熔点比金属铝的熔点高 |
D | Na2O2具有强氧化性 | Na2O2可以作为漂白剂 |
A. A B. B C. C D. D
【题目】某化学小组同学欲在实验室中用乙醇制备1,2-二溴乙烷。
甲同学设计的实验装置如下图:
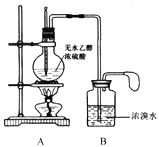
(1)请写出A和B中发生的主要反应的化学方程式
A:________________________________________。
B:________________________________________。
(2)乙同学查阅资料得知:
①此反应可能存在的主要副反应有:在浓硫酸的存在下,乙醇可发生如下反应生成乙醚, ![]()
②乙醚不与溴水反应
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
颜色、状态 | 无色液体 | 无色液体 | 无色液体 |
沸点/℃ | 78.5 | 132 | 34.6 |
若最终产物中混有少量乙醚,可用__________的方法除去。
(3)丙同学观察到:在实验后期A中液体变黑,认为应该在装置A和B之间加入装置__________(填序号),此装置的作用是____________________。