题目内容
(14分)金属钛素有“太空金属”、“未来金属”等美誉。工业上,以钛铁矿为原料制备二氧化钛并得到副产品FeSO4·7H2O(绿矾)的工艺流程如下图所示。
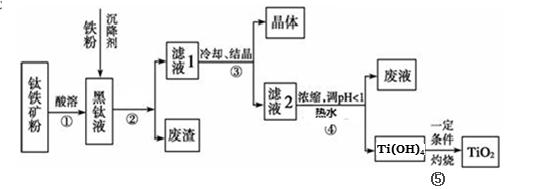
已知:TiO2+在一定条件下会发生水解;钛铁矿主要成分为钛酸亚铁(FeTiO3),含有少量SiO2杂质;其中一部分铁元素在钛铁矿处理过程中会转化为+3价。
(1)黑钛液中生成的主要阳离子有TiO2+和Fe2+,写出步骤①化学反应方程式:_________;
步骤②中,加入铁粉的主要目的是 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均涉及到的操作是 (填操作名称);在实验室完成步骤⑤“灼 烧”所需主要仪器有 。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为Ti(OH)4 的原因:
。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为 。
(6)实验室通过下面方法可测定副产品绿矾中FeSO4·7H2O的质量分数。
a.称取2.85g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为19.00mL(滴定时发生反应的离子方程式为:Fe2++MnO4-+H+→Fe3++Mn2++H2O 未配平 )。
计算上述样品中FeSO4·7H2O的质量分数为 (用小数表示,保留二位小数)。

已知:TiO2+在一定条件下会发生水解;钛铁矿主要成分为钛酸亚铁(FeTiO3),含有少量SiO2杂质;其中一部分铁元素在钛铁矿处理过程中会转化为+3价。
(1)黑钛液中生成的主要阳离子有TiO2+和Fe2+,写出步骤①化学反应方程式:_________;
步骤②中,加入铁粉的主要目的是 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均涉及到的操作是 (填操作名称);在实验室完成步骤⑤“灼 烧”所需主要仪器有 。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为Ti(OH)4 的原因:
。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为 。
(6)实验室通过下面方法可测定副产品绿矾中FeSO4·7H2O的质量分数。
a.称取2.85g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为19.00mL(滴定时发生反应的离子方程式为:Fe2++MnO4-+H+→Fe3++Mn2++H2O 未配平 )。
计算上述样品中FeSO4·7H2O的质量分数为 (用小数表示,保留二位小数)。
(14分)(1)FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O; (2分)
将Fe3+转化为Fe2+并防止Fe2+被氧化 (2分)
(2)b (1分)
(3)过滤 (1分) 坩埚(酒精灯、三脚架、泥三角不填不扣分,填错扣分,“坩埚”错别字不给分)(2分)
(4)溶液中存在平衡:TiO2+ + 3H2O Ti(OH)4 + 2H+,当加入热水稀释、升温后,
Ti(OH)4 + 2H+,当加入热水稀释、升温后,
平衡正向移动,生成Ti(OH)4。 (2分)
(5)MnO2 + 2Fe2+ + 4H+ ="==" Mn2+ + 2Fe3+ + 2H2O (2分)
(6) 0.93(2分)
将Fe3+转化为Fe2+并防止Fe2+被氧化 (2分)
(2)b (1分)
(3)过滤 (1分) 坩埚(酒精灯、三脚架、泥三角不填不扣分,填错扣分,“坩埚”错别字不给分)(2分)
(4)溶液中存在平衡:TiO2+ + 3H2O
 Ti(OH)4 + 2H+,当加入热水稀释、升温后,
Ti(OH)4 + 2H+,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4。 (2分)
(5)MnO2 + 2Fe2+ + 4H+ ="==" Mn2+ + 2Fe3+ + 2H2O (2分)
(6) 0.93(2分)
试题分析:(1)钛铁矿主要成分为钛酸亚铁(FeTiO3),酸溶后得TiO2+和Fe2+,所以步骤①化学反应方程式为:FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O;因为一部分铁元素在钛铁矿处理过程中会转化为+3价,所以加入铁粉目的是将Fe3+转化为Fe2+并防止Fe2+被氧化;
(2)步骤③中,冷却、结晶将物质分离,是利用了物质的溶解性的不同,所以答案选b;
(3)步骤②、③、④中都是固、液分离,所以涉及到的操作是过滤;步骤⑤“灼烧”所需主要仪器有坩埚、酒精灯、三脚架、泥三角;
(4)步骤④溶液中存在平衡:TiO2+ + 3H2O
 Ti(OH)4 + 2H+,水解反应是吸热反应,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4。
Ti(OH)4 + 2H+,水解反应是吸热反应,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4。(5)废液中含有未结晶的Fe2+,与二氧化锰发生氧化还原反应,生成Fe3+、Mn2+,离子方程式为MnO2 + 2Fe2+ + 4H+ ="==" Mn2+ + 2Fe3+ + 2H2O ;
(6)根据得失电子守恒规律,n(FeSO4·7H2O)=5n(KMnO4),250mL的溶液中n(FeSO4·7H2O)=19.00×10-3L×0.01mol/L×10×5=9.5×10-3mol,所以绿矾样品中FeSO4·7H2O的质量分数为9.5×10-3mol×278g/mol÷2.85g=0.93。

练习册系列答案
相关题目
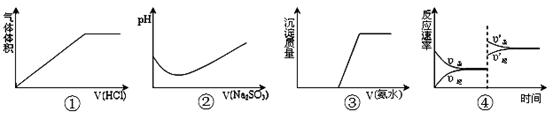
 2SO3 ΔH< 0 ,达平衡后,增大压强
2SO3 ΔH< 0 ,达平衡后,增大压强 CuS(s)+Mn2+(aq),下列说法错误的是 ( )
CuS(s)+Mn2+(aq),下列说法错误的是 ( )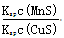
 2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
 减小
减小 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表: 2CO(g)+2H2(g) 的△H= ;
2CO(g)+2H2(g) 的△H= ;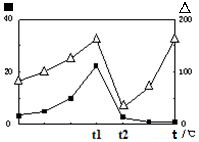 (?代表CO的生成速率,■代表催化剂的催化效率)
(?代表CO的生成速率,■代表催化剂的催化效率) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
 2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。 2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是 ( )
2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是 ( )