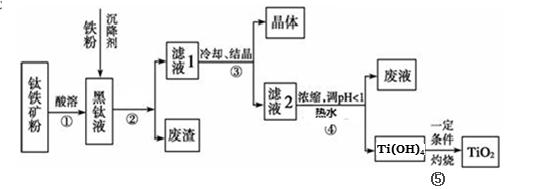
题目内容
下列实验过程中曲线变化不正确的是
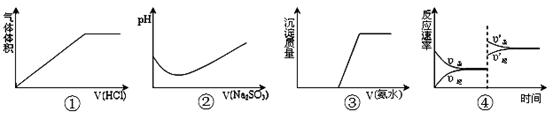

| A.①表示Na2CO3溶液中滴入稀盐酸 |
| B.②表示溴水中滴入Na2SO3溶液 |
| C.③表示HCl和MgCl2溶液中滴入氨水 |
D.④表示一定条件下反应:2SO2+O2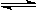 2SO3 ΔH< 0 ,达平衡后,增大压强 2SO3 ΔH< 0 ,达平衡后,增大压强 |
A
试题分析:A.反应CO32-+H+=HCO3- HCO3-+H+=CO2↑+H2O,开始时没有气体产生,错误;B.Br2+SO32-+H2O=2Br-+SO42-+2H+,前一段时间有溴存在的时候,由方程式可知PH会下降,但当溴反应完后,由于亚硫酸钠是强碱弱酸盐显碱性,继续加入则PH上升,正确;C.氨水先和HCl反应,再和MgCl2溶液反应,所以在有盐酸存在时,没有沉淀产生,正确;D.增大压强,同时增大正逆反应速率,同时平衡向着体积减小的方向移动,即向正反应方向移动,所以正反应速率大于逆反应速率,正确。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
 2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是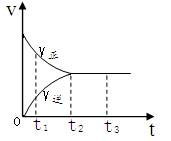
 2SO3(g);ΔH=-197.74 kJ·mol-1。
2SO3(g);ΔH=-197.74 kJ·mol-1。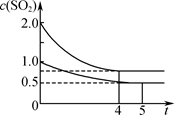
 4P (g)+Q(g)
4P (g)+Q(g)
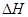 <0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是:
<0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是:
 >45
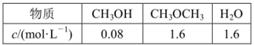
>45
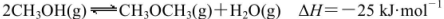 。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是
。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是