题目内容
在密闭容器中进行N2+3H2 2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是 ( )
2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是 ( )
 2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是 ( )
2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是 ( )| A.40 mol 35% | B.20 mol 30% |
| C.20 mol 70% | D.10 mol 50% |
C
根据题意:可推算出反应达到平衡时各组成成分的物质的量。
N2+ 3H2 2NH3
2NH3
起始量 10 mol 30 mol 0
变化量 10×30%=3 mol 9 mol 6 mol
平衡量 7 mol 21 mol 6 mol
从逆向思维考虑,若正反应进行到底,可求得生成NH3 20 mol,此NH3的物质的量就是从逆向进行上述反应时,NH3的起始反应量。
在同温和同一容器中进行逆向反应达到平衡时,各组成成分的物质的量与上述反应相同。
N2+ 3H2 2NH3
2NH3
起始量 0 0 20 mol
平衡量 7 mol 21 mol 20-14=6 mol
可见NH3起始量20 mol
NH3的转化率: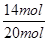 ×100%=70%。
×100%=70%。
N2+ 3H2
 2NH3
2NH3起始量 10 mol 30 mol 0
变化量 10×30%=3 mol 9 mol 6 mol
平衡量 7 mol 21 mol 6 mol
从逆向思维考虑,若正反应进行到底,可求得生成NH3 20 mol,此NH3的物质的量就是从逆向进行上述反应时,NH3的起始反应量。
在同温和同一容器中进行逆向反应达到平衡时,各组成成分的物质的量与上述反应相同。
N2+ 3H2
 2NH3
2NH3起始量 0 0 20 mol
平衡量 7 mol 21 mol 20-14=6 mol
可见NH3起始量20 mol
NH3的转化率:
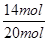 ×100%=70%。
×100%=70%。 
练习册系列答案
相关题目
 CO2(g)+2H2O(g)
CO2(g)+2H2O(g)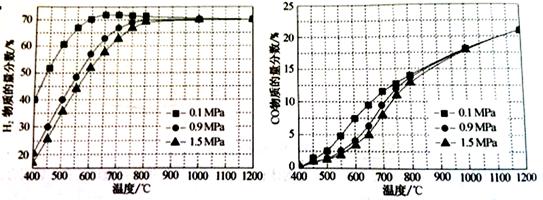
 CH3OH(g) △H= 。
CH3OH(g) △H= 。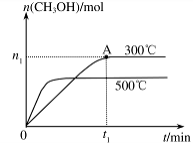
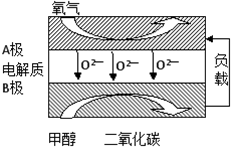
 2SO3的说法中正确的是
2SO3的说法中正确的是 I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是 4C(g),达平衡时c(A)=1.00mol?L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol?L-1,则下列说法正确的是 ( )
4C(g),达平衡时c(A)=1.00mol?L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol?L-1,则下列说法正确的是 ( )
 CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示: