题目内容
某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是
A.c(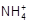 )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) | B.c(Cl-)>c(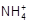 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
C.c(Cl-)>c(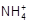 )>c(H+)>c(OH-) )>c(H+)>c(OH-) | D.c(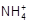 )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-) |
D
试题分析:氨水和盐酸发生中和反应生成氯化铵和水,则根据电荷守恒可知c(
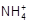 )+c(H+)=c(Cl-)+c(OH-),所以选项D正确,AB不正确;由于氨水是弱碱,且a+b=14,所以在反应中氨水是过量的,溶液显碱性,应该是c(
)+c(H+)=c(Cl-)+c(OH-),所以选项D正确,AB不正确;由于氨水是弱碱,且a+b=14,所以在反应中氨水是过量的,溶液显碱性,应该是c(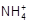 )>c(Cl-)>c(OH-)>c(H+),C不正确,答案选D。
)>c(Cl-)>c(OH-)>c(H+),C不正确,答案选D。点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确酸碱中和后溶液酸碱性的判断,首先要判断酸碱的过量问题。只有当酸碱恰好反应时,才能考虑生成的盐是否水解,其次要利用好电荷守恒、物料守恒以及质子守恒。

练习册系列答案
相关题目
 NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)
NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)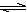 H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液: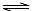 H2A+OH―
H2A+OH―