题目内容
15.下列说法正确的是( )| A. | 在 101kPa 下,1克物质燃烧所放出的热量叫做该物质的热值 | |
| B. | 金属的防腐处理中,牺牲阳极的阴极保护法是电解池原理的应用 | |
| C. | 活化分子间的碰撞就是有效碰撞 | |
| D. | 催化剂能增大单位体积内活化分子百分数,从而增大反应速率 |
分析 A、根据热值的概念来分析;
B、牺牲阳极的阴极保护法是原电池原理;
C、发生反应的碰撞为有效碰撞;
D、催化剂能降低反应的活化能.
解答 解:A、1g物质完全燃烧生成稳定的氧化物时所放出的热量称为该物质的热值,故A错误;
B、在原电池中,负极被消耗,正极被保护,牺牲阳极的阴极保护法是原电池原理,故B错误;
C、发生反应的碰撞才为有效碰撞,活化分子之间的碰撞不一定是有效碰撞,但有效碰撞一定发生在活化分子之间,故C错误;
D、催化剂能降低反应的活化能,从而提高单位体积内的活化分子个数和活化分子百分数,从而加快反应速率,故D正确;
故选D.
点评 本题考查了金属腐蚀防护的方法、有效碰撞以及催化剂能加快反应速率的原因,难度不大,应注意的是活化分子之间的碰撞不一定是有效碰撞,但有效碰撞一定发生在活化分子之间.

练习册系列答案
相关题目
5. 乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下:
乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下: +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:

(1)装置B的名称是:球形冷凝管
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸; 第二次水洗的主要目的是:洗掉碳酸氢钠
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后D(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高醇的转化率
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯;
(6)在蒸馏操作中,如图2仪器选择及安装都正确的是:b(填标号)
(7)本实验的产率是:C
A.30% B.40% C.50% D.60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量的未反应的异戊醇.
 乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下:
乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下: +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O| 相对分子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙醇 | 60 | 1.0492 | 118 | 溶 |
| 乙醇异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:

(1)装置B的名称是:球形冷凝管
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸; 第二次水洗的主要目的是:洗掉碳酸氢钠
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后D(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高醇的转化率
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯;
(6)在蒸馏操作中,如图2仪器选择及安装都正确的是:b(填标号)
(7)本实验的产率是:C
A.30% B.40% C.50% D.60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量的未反应的异戊醇.
3.下列说法正确的是( )
| A. | 焓减小的反应通常是自发的,能够自发进行的反应都是焓减小的反应 | |
| B. | 熵增加的反应通常是自发的,能够自发进行的反应都是熵增加的反应 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | △G<0的反应是自发的,因此在任何条件均可发生 |
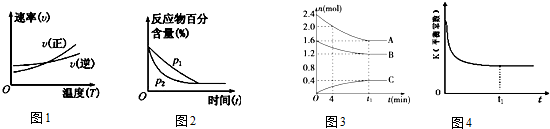
20.对下列图象的描述中,正确的
 ( )
( )
 ( )
( )| A. | 根据图①可判断正反应的△H<0 | |
| B. | 图②可表示压强(p)对反应 2A(g)+2B(g)?3C(g)+D(s)的影响,P2 的压强大 | |
| C. | 图③可以表示的反应为 2A(g)+B(g)?C(g)△H<0 | |
| D. | 图④表示一定条件下,在绝热、恒容的密闭体系中进行的反应:NO(g)+NO2(g)?N2O3(g)△H<0,t1 时刻达到平衡状态 |
4.关于SO2的叙述中,正确的是( )
| A. | SO2的摩尔质量是64g | |
| B. | 1molSO2中所含分子数约为6.02×1023 | |
| C. | 1molSO2的质量是64g/mol | |
| D. | 常温常压下,1mol SO2的体积为22.4L |
5.下列离子方程式中,正确的是( )
| A. | 碳酸钙与盐酸混合 2H++CO32-═CO2↑+H2O | |
| B. | 向氯化铁溶液中加入铁粉 Fe3++Fe═2Fe2+ | |
| C. | 亚硫酸钠溶液与稀硫酸混合 2H++SO32-═SO2↑+H2O | |
| D. | 二氧化锰与浓盐酸混合后加热 MnO2+4H++4Cl-═MnCl2+Cl2↑+2H2O |
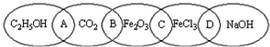 如图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号,请回答下列问题:
如图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号,请回答下列问题: HCO3-+OH-(用离子方程式表示);
HCO3-+OH-(用离子方程式表示);