题目内容
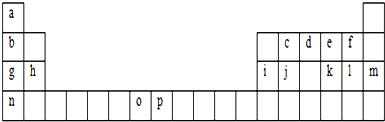
下表是元素周期表的一部分,试回答下列问题
(1)表中金属性最强的元素位于周期表第 周期 族.
(2)表中元素②、③、④的简单气态氢化物稳定性由强到弱的顺序是 (填数字序号).
(3)表中元素①、②、⑤、⑥中,原子半径由大到小的顺序是 (填数字序号).
(4)工业上冶炼元素⑤单质的化学方程式为 .
(5)表中元素⑧的单质与⑩的氢化物在水溶液中反应的离子方程式为 .
(6)表中元素①、③可形成一种相对分子质量为19的离子化合物X,X的电子式为 .
(7)表中元素③、④可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式为 .
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||||
| ⑨ | ⑩ | ||||||||||||||||
(2)表中元素②、③、④的简单气态氢化物稳定性由强到弱的顺序是
(3)表中元素①、②、⑤、⑥中,原子半径由大到小的顺序是
(4)工业上冶炼元素⑤单质的化学方程式为
(5)表中元素⑧的单质与⑩的氢化物在水溶液中反应的离子方程式为
(6)表中元素①、③可形成一种相对分子质量为19的离子化合物X,X的电子式为
(7)表中元素③、④可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中位置知,①为H、②为C、③为N、④为F、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为K、⑩为Br.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;
(2)同周期自左而右非金属性增强,非金属性越强,氢化物越稳定;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H元素原子半径最小;
(4)工业上电解熔融的氯化钠冶炼钠单质;
(5)氯气与HBr反应生成HCl与溴单质;
(6)元素①、③可形成一种相对分子质量为19的离子化合物X为NH4H;
(7)元素③、④可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y为N2F2,N原子之间形成2对共用电子对,每个N原子与F原子之间形成1对共用电子对.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;
(2)同周期自左而右非金属性增强,非金属性越强,氢化物越稳定;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H元素原子半径最小;
(4)工业上电解熔融的氯化钠冶炼钠单质;
(5)氯气与HBr反应生成HCl与溴单质;
(6)元素①、③可形成一种相对分子质量为19的离子化合物X为NH4H;
(7)元素③、④可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y为N2F2,N原子之间形成2对共用电子对,每个N原子与F原子之间形成1对共用电子对.
解答:
解:根据元素在周期表中位置知,①为H、②为C、③为N、④为F、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为K、⑩为Br.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素后者K元素金属性最强,处于第四周期ⅠA族,故答案为:四;ⅠA;
(2)同周期自左而右非金属性增强,故非金属性②<③<④,非金属性越强,氢化物越稳定,故氢化物稳定性④>③>②,故答案为:④>③>②;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H元素原子半径最小,故原子半径:⑤>⑥>②>①,故答案为:⑤>⑥>②>①;
(4)工业上电解熔融的氯化钠冶炼钠单质,化学反应方程式为:2NaCl(熔融)
2Na+Cl2↑,故答案为:2NaCl(熔融)
2Na+Cl2↑;
(5)氯气与HBr反应生成HCl与溴单质,反应离子方程式为:Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-;
(6)元素①、③可形成一种相对分子质量为19的离子化合物X为NH4H.其电子式为: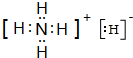 ,故答案为:
,故答案为: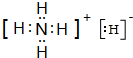 ;
;
(7)元素③、④可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y为N2F2,N原子之间形成2对共用电子对,每个N原子与F原子之间形成1对共用电子对,其结构式为F-N=N-F,故答案为:F-N=N-F.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素后者K元素金属性最强,处于第四周期ⅠA族,故答案为:四;ⅠA;
(2)同周期自左而右非金属性增强,故非金属性②<③<④,非金属性越强,氢化物越稳定,故氢化物稳定性④>③>②,故答案为:④>③>②;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H元素原子半径最小,故原子半径:⑤>⑥>②>①,故答案为:⑤>⑥>②>①;
(4)工业上电解熔融的氯化钠冶炼钠单质,化学反应方程式为:2NaCl(熔融)
| ||
| ||
(5)氯气与HBr反应生成HCl与溴单质,反应离子方程式为:Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-;
(6)元素①、③可形成一种相对分子质量为19的离子化合物X为NH4H.其电子式为:
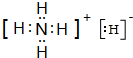 ,故答案为:
,故答案为: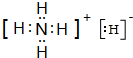 ;
;(7)元素③、④可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y为N2F2,N原子之间形成2对共用电子对,每个N原子与F原子之间形成1对共用电子对,其结构式为F-N=N-F,故答案为:F-N=N-F.
点评:本题考查元素周期表与元素周期律综合应用,根据元素在周期表中等位置确定元素,注意元素周期律的理解掌握,(6)(7)为易错点,中学基本不及负价氢元素化合物,注意根据氮气的结构理解N2F2的结构.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=+Q kJ/mol(Q>0)达到平衡.缩小容器体积,重新达到平衡,C的浓度比原平衡的浓度大.以下分析正确的是( )
| A、产物B的状态只能为固态或液态 |
| B、平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 |
| C、保持体积不变,向平衡体系中加入B,平衡不可能向逆反应方向移动 |
| D、若开始时向容器中加入1mol B和1mol C,达到平衡时放出热量QkJ |
下列化学用语正确的是( )
| A、C2H2分子的结构式:H-C≡C-H |
| B、NaH与重水反应的方程式:NaH+D2O=NaOH+D2↑ |
C、S2-的结构示意图: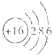 |
D、二氧化碳的电子式: |
 (1)15.6g Na2X含Na+0.4moL,则Na2X的摩尔质量为
(1)15.6g Na2X含Na+0.4moL,则Na2X的摩尔质量为