题目内容
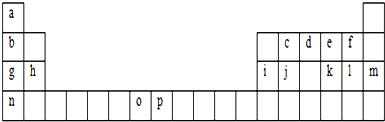
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子外围电子排布式: .
(2)c与a形成6个原子组成分子结构简式: ,该分子是: (填“极性”或“非极性”)分子.
(3)表中O、P两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态P2+再失去一个电子难.对此,你的解释是 ;
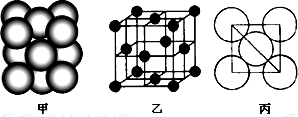
(4)i单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 .

试回答下列问题:
(1)元素p为26号元素,请写出其基态原子外围电子排布式:
(2)c与a形成6个原子组成分子结构简式:
(3)表中O、P两元素的部分电离能数据列于下表:
| 元 素 | O | P | |
| 电离能 kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)i单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.

晶胞中i原子的配位数为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,a、b、c、d、e、f、g、h、i、j、k、l、m、n、o、p元素分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素,
(1)元素p为26号元素,其3d、4s电子为其外围电子即价电子,3d能级上有6个电子、4s能级上有2个电子,据此其价电子排布式;
(2)c与a形成6个原子组成分子乙烯,其结构简式为CH2=CH2,正负电荷重心重合的分子为非极性分子;
(3)原子轨道处于半满、全满、全空时能量最低最稳定;
(4)i为Al元素,该晶胞中Al原子配位数=3×8×
,利用均摊法计算晶胞中Al原子个数.
(1)元素p为26号元素,其3d、4s电子为其外围电子即价电子,3d能级上有6个电子、4s能级上有2个电子,据此其价电子排布式;
(2)c与a形成6个原子组成分子乙烯,其结构简式为CH2=CH2,正负电荷重心重合的分子为非极性分子;
(3)原子轨道处于半满、全满、全空时能量最低最稳定;
(4)i为Al元素,该晶胞中Al原子配位数=3×8×
| 1 |
| 2 |
解答:
根据元素在周期表中的位置知,a、b、c、d、e、f、g、h、i、j、k、l、m、n、o、p元素分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素,
(1)元素p为26号元素,其3d、4s电子为其外围电子即价电子,3d能级上有6个电子、4s能级上有2个电子,其价电子排布式为3d64s2,故答案为:3d64s2;
(2)c与a形成6个原子组成分子乙烯,其结构简式为CH2=CH2,乙烯结构对称,正负电荷重心重合,所以为非极性分子,故答案为:CH2=CH2;非极性;
(3)Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:Mn2+的3d轨道电子为半充满状态较稳定;
(4)i为Al元素,该晶胞中Al原子配位数=3×8×
=12,晶胞中Al原子个数=8×
+6×
=4,故答案为:12;4.
(1)元素p为26号元素,其3d、4s电子为其外围电子即价电子,3d能级上有6个电子、4s能级上有2个电子,其价电子排布式为3d64s2,故答案为:3d64s2;
(2)c与a形成6个原子组成分子乙烯,其结构简式为CH2=CH2,乙烯结构对称,正负电荷重心重合,所以为非极性分子,故答案为:CH2=CH2;非极性;
(3)Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:Mn2+的3d轨道电子为半充满状态较稳定;
(4)i为Al元素,该晶胞中Al原子配位数=3×8×
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
点评:本题考查了物质结构和性质,涉及原子核外电子排布、晶胞计算等知识点,利用均摊法计算晶胞中原子个数,知道核外电子排布特点及规则,题目难度中等.

练习册系列答案
相关题目
已建立化学平衡的可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述中正确的是( )
| A、生成物的质量分数一定增大 |
| B、反应物的转化率一定增大 |
| C、正反应的速率一定增大 |
| D、正反应速率一定大于逆反应速率 |
 甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )
甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )| A、该混合溶液中的SO42-导致了A点溶液的pH值小于B点 |
| B、AB线段与BC线段在阴极上发生的反应是相同的,即:Cu2++2e-→Cu |
| C、BC段阴极产物和阳极产物的体积之比为2:1 |
| D、在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀 |