题目内容
【题目】实验室制Cl2的反应为4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O.下列说法错误的( )
MnCl2+Cl2↑+2H2O.下列说法错误的( )
A.还原剂是HCl,氧化剂是MnO2
B.每消耗1 mol HCl,转移电子的物质的量为2 mol
C.每生成1 mol Cl2 , 转移电子的物质的量为2 mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
【答案】B
【解析】A.Mn元素的化合价降低,Cl元素的化合价升高,还原剂是HCl,氧化剂是MnO2,故A不符合题意;
B.由反应方程式可知每消耗4 mol HCl,得到2mol电子,故B符合题意;
C.每生成1molCl2,转移电子的物质的量为1mol×2×(1﹣0)=2mol,故C不符合题意;
D.盐酸易挥发,则生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质,故D不符合题意;
所以答案是:B.

【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程图如下:
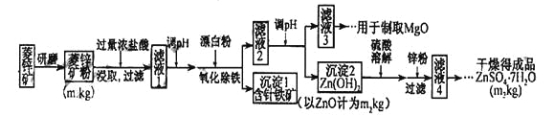
(1)将菱锌矿研磨成粉的目的是___________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+ □____+ □_____="=" □Fe(OH)3+ □Cl_
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H ,化学式式量为89,化学式是_______ 。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______ 。
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
Ksp | 5.6×10-12 | — | 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是_________(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为 ______ 、_______ 、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnC3的质量分数不低于 。

