题目内容
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
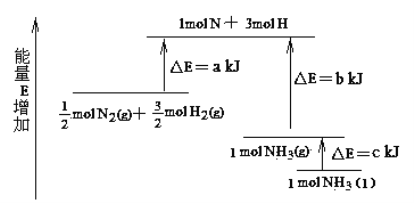
A. N2(g)+3H2(g) = 2NH3(g) ;△H = 2(b—a) kJ/mol
B. N2(g)+3H2(g) = 2NH3(l); △H = 2(a—b—c) kJ/mol
C. N2(g)+3H2(g) = 2NH3(l) ;△H = (b+c—a) kJ/mol
D. N2(g)+3H2(g) = 2NH3(g) ;△H = (a+b) kJ/mol
【答案】B
【解析】从图象看,热化学方程式为:①![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(l);△H=-(b+c-a) kJ/mol;或②
NH3(l);△H=-(b+c-a) kJ/mol;或②![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g);△H=(a-b) kJ/mol,△H与化学计量数成正比,以此分析。
NH3(g);△H=(a-b) kJ/mol,△H与化学计量数成正比,以此分析。
从图象看,热化学方程式为:①![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(l)△H=-(b+c-a) kJ/mol;或②
NH3(l)△H=-(b+c-a) kJ/mol;或②![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g);△H=(a-b) kJ/mol,△H与化学计量数成正比,①×2可得:N2(g)+3H2(g)═2NH3(l)△H=2(a-b-c) kJ/mol,②×2可得:N2(g)+3H2(g)═2NH3(g)△H=2(a-b) kJ/mol,答案选B。
NH3(g);△H=(a-b) kJ/mol,△H与化学计量数成正比,①×2可得:N2(g)+3H2(g)═2NH3(l)△H=2(a-b-c) kJ/mol,②×2可得:N2(g)+3H2(g)═2NH3(g)△H=2(a-b) kJ/mol,答案选B。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:

已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有______。(回答两条即可)
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为_______。

(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去________ (填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式_______(填化学式);碳化时发生反应的化学方程式为______。
(5)把CaCO3浊液滴入1.0molL-1 的Na2SO3溶液中,能否产生CaSO3沉淀?_______。若不能,说明原因;若能,请从定量的角度简述判断依据:_______。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9]
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:__________。
【题目】元素A~D是元素周期表中短周期的四种元素,根据表中信息回答下列问题。
元素 | 性质或结构信息 |
A | 单质制成的高压灯,发出的黄光透雾力强、射程远。且其单质燃烧后生成淡黄色固体 |
B | 单质非常稳定,是空气的主要成分之一。其原子的最外层电子数是内层电子总数的2.5倍 |
C | 单质是双原子分子,常温、常压下是黄绿色气体,原子的M层再增加一个电子即达到稳定结构 |
D | +2价阳离子的核外电子排布与氖原子相同 |
(1)上表四种元素名称分别为:A____,B____,C____,D____。
(2)A、B、C、D原子半径由大到小的顺序为___。(用元素符号填写)
(3)写出B的气态氢化物与其最高价氧化物对应的水化物反应的离子方程式____。
(4)用电子式表示AC的形成过程____。
(5)C元素的单质的氧化性比溴单质的氧化性____(填“强”或“弱”),请设计实验证明___。(写实验操作和现象)

