题目内容
1.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40-500C时反应可生成它.CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生反应是2Cu+=Cu2++Cu.根据以上信息,结合自己所掌握的化学知识,回答:(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是还原剂.
(2)写出CuH在氯气中燃烧的化学反应方程式2CuH+3Cl2═2CuCl2+2HCl.
(3)CuH溶解在稀盐酸中生成的气体是H2,如果反应中生成了标准状况下22.4L的气体,被还原的离子得电子的物质的量是1.5mol.
(4)在探究酸性条件下2Cu+=Cu2++Cu的反应时,能否选用硝酸,说明理由不能,硝酸具有强氧化性,会直接将Cu+氧化为Cu2+.
分析 (1)根据化合价的变化判断氧化剂、还原剂;
(2)CuH在氯气中燃烧,氯气做氧化剂,CuH做还原剂;
(3)CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,据此分析计算即可;
(4)硝酸具有强氧化性和铜、亚铜离子发生氧化还原反应生成铜离子;
解答 解:(1)根据化合价的变化判断,CuSO4做氧化剂、所以另一物质做还原剂,故答案为:还原剂;
(2)CuH在氯气中燃烧,氯气做氧化剂,CuH做还原剂,所以反应方程式为:2CuH+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl,故答案为:2CuH+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl;
(3)CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,所以得到的气体是H2;在此反应中CuH中Cu的化合价由+1价升高到+2价,H的化合价由-1价升高到0价,故反应方程式为:2CuH+2H2SO4=2CuSO4+3H2↑,已知生成气体的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,故依据方程式得出转移电子数为1.5mol,
故答案为:H2;1.5mol
(4)在探究酸性条件下2Cu+=Cu2++Cu的反应时,不能选用硝酸,硝酸具有强氧化性,会直接将Cu+氧化为Cu2+,硝酸具有强氧化性和铜、亚铜离子发生氧化还原反应生成铜离子,
故答案为:硝酸具有强氧化性和铜、亚铜离子发生氧化还原反应生成铜离子;
点评 本题是信息给予题,筛选有用信息结合已学知识进行整合处理,主要是铜及其化合物性质的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 同物质的量的N2和HCl的原子数相同,分子数也相同 | |
| B. | 0.05mol H2SO4含有氧原子数的精确值为1.024×1023 | |
| C. | 0.1mol氯的微粒数约为6.02×1023个 | |
| D. | 1mol NaClO含有阿伏加德罗常数个氯分子 |
12.下列物质分类正确的是( )
| A. | SO2、SiO2、NO2均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 汽油、水玻璃、氨水均为混合物 |
9.下列各组元素按第一电离能增加顺序排列的是( )
| A. | Na、Al、Mg | B. | Be、B、Li | C. | Li、Na、K | D. | O、F、N |
10.有关化学用语正确的是( )
| A. | 氨气的结构式为 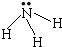 | B. | 醛基的结构简式:-COH | ||
| C. | 羟基的电子式: | D. | 甲醇的球棍模型: |
11.在无色透明的碱性溶液中能大量共存的离子组是( )
| A. | K+、Cl-、MnO4-、SO42- | B. | Na+、K+、AlO2-、NO3- | ||
| C. | Na+、NO3-、SO42-、HCO3- | D. | Na+、Cu2+、NO3-、CO32- |

 .写出E→F反应的化学方程式
.写出E→F反应的化学方程式 .
.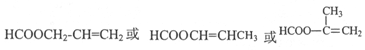 .
.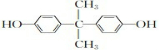 .
.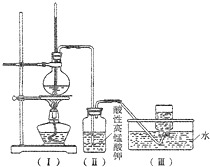 如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.
如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.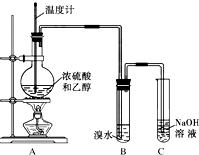 为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.
为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.