题目内容
13.可逆反应2SO2+O2?2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol•L-1•min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol•L-1•min-1)表示,当反应达到化学平衡时,正确的关系是( )
①v(SO2)=v′(SO2)②v(O2)=v′(SO2)=v(SO3)
③v(O2)=$\frac{1}{2}$v′(SO2)④v′(SO2)=v′(O2)=v′(SO3)
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | ①③ |
分析 当反应达到平衡时,正反应速率和逆反应速率相等,即同一种物质的生成速率与分解速率相等;用不同物质表示的反应速率,必须用“化学反应速率之比等于化学计量数之比”换算成同一种物质的反应速率,才能比较.
解答 解:①v(SO2)=v′(SO2),表示正逆反应速率相等,处于平衡状态,故正确;
②v(O2)=v′(SO2)=v(SO3),由于氧气和二氧化硫的化学计量数之比为1:2,若处于平衡状态,应该满足2v(O2)=v′(SO2),故错误;
③v(O2)=$\frac{1}{2}$v′(SO2),由于氧气和二氧化硫的化学计量数之比为1:2,故正确;
D、v′(SO2)=v′(O2)=v′(SO3),表示的都是逆反应速率,无法判断是否达到平衡状态,故错误;
故选D.
点评 本题考查了化学反应速率与化学计量数的关系、化学平衡状态的判断,题目难度中等,注意明确化学计量数与化学反应速率成正比、正逆反应速率相等是化学平衡状态的特征.

练习册系列答案
相关题目
3.关于方程:3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O下列叙述正确的是( )
| A. | 当有12.8gCu参加反应,转移的电子数为0.4NA个 | |
| B. | 还原剂是Cu,还原产物是Cu(NO3)2 | |
| C. | 反应中HNO3既表现为酸性又表现为还原性 | |
| D. | Cu(NO3)2既是氧化产物又是还原产物 |
4.下列热化学方程式中△H表示可燃物燃烧热的是( )
| A. | C(s)+$\frac{1}{2}$ O2(g)=CO(g)△H=-110.5 kJ/mol | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$ O22(g)=CO2(g)△H=-283.0kJ/mol |
1.下列现象或反应的原理解释正确的是( )
| 现象或反应 | 原理解释 | |
| A | 锌与盐酸反应时,加入几滴氯化铜溶液可加快反应速率 | 氯化铜作反应的催化剂 |
| B | 将一小块金属钠投入水中,金属钠熔成小球 | 该反应△H>0 |
| C | 镀层破损后,镀锡铁比镀锌铁易腐蚀 | 锡比锌活泼 |
| D | 把铜片插入三氯化铁溶液中,在铜片表面不能出现一层铁 | Cu+2Fe3+=Cu2++2Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
18.下列说法正确的是( )
| A. | 原子的电子层数越多,原子半径一定越大 | |
| B. | 37号元素位于周期表中第五周期 | |
| C. | 同族元素相差的原子序数可能为16、26、36、46 | |
| D. | 卤族元素的单质均有氧化性,最高正价都是+7 |
5.下列数量的物质中含原子个数最多的是( )
| A. | 0.4 mol氧气 | B. | 5.4 g H2O | ||
| C. | 标准状况下5.6 L二氧化碳 | D. | 10 g氖 |
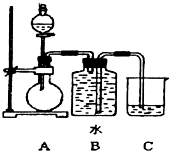 如图装置可以用来制取某些气体.
如图装置可以用来制取某些气体.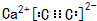 (填电子式)分液漏斗中盛放的是饱和食盐水,目的是使反应产生乙炔的速率平缓.
(填电子式)分液漏斗中盛放的是饱和食盐水,目的是使反应产生乙炔的速率平缓.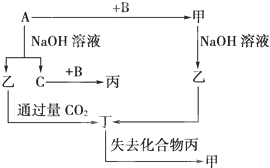
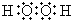 .
.