题目内容
1.下列现象或反应的原理解释正确的是( )| 现象或反应 | 原理解释 | |
| A | 锌与盐酸反应时,加入几滴氯化铜溶液可加快反应速率 | 氯化铜作反应的催化剂 |
| B | 将一小块金属钠投入水中,金属钠熔成小球 | 该反应△H>0 |
| C | 镀层破损后,镀锡铁比镀锌铁易腐蚀 | 锡比锌活泼 |
| D | 把铜片插入三氯化铁溶液中,在铜片表面不能出现一层铁 | Cu+2Fe3+=Cu2++2Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.锌置换出铜,形成原电池反应;
B.金属钠熔成小球,说明反应放热;
C.镀层破损后,镀锡铁中铁为负极,易被氧化;
D、Cu能够与铁离子反应生成亚铁离子和铜离子.
解答 解:A.锌置换出铜,形成原电池反应,反应速率增大,故A错误;
B.金属钠熔成小球,说明反应放热,该反应△H<0,故B错误;
C.镀层破损后,铁比锡活泼,镀锡铁中铁为负极,易被氧化,镀锌铁中,Fe为正极不易被腐蚀,锌比锡活泼,故C错误;
D.Cu能够与铁离子反应生成亚铁离子和铜离子,在铜片表面不能出现一层铁,反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+,故D正确.
故选D.
点评 本题考查较为综合,涉及多方面的知识,为高频常见题型,注意把握原电池以及金属的腐蚀,钠与水反应的特点等,难度不大.

练习册系列答案
相关题目
11.常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应.上述两种方法都可制得的氯化物是( )
| A. | CuCl2 | B. | ZnCl2 | C. | FeCl3 | D. | AlCl3 |
16.下列说法正确的是( )
| A. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| C. | 在同一条件下,不同物质有不同的焓值,其体系的混乱程度越大,焓值越大 | |
| D. | AgCl在浓度相同的MgCl2溶液和KCl溶液中的溶解度相同 |
10.下列物质中不能发生银镜反应的是( )
| A. | 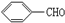 | B. | HCOOH | C. | HCOOC2H5 | D. |  |
16.下列物质间不能发生反应的是( )
| A. | H2SO4和Ba(OH)2 | B. | CO2和NaOH | C. | CaCO3和HCl | D. | Na2CO3和K2SO4 |

