题目内容
18.下列说法正确的是( )| A. | 原子的电子层数越多,原子半径一定越大 | |
| B. | 37号元素位于周期表中第五周期 | |
| C. | 同族元素相差的原子序数可能为16、26、36、46 | |
| D. | 卤族元素的单质均有氧化性,最高正价都是+7 |
分析 A、原子半径由电子层数、核电荷数等因素共同决定;
B、37号元素为铷,处于第IA族第五周期;
C、同族元素相差的原子序数可能为2、8、18、32,不可能相差36、46;
D、氟元素是最活泼的非金属元素,无正价.
解答 解:A、原子核对核外电子的吸引,核外电子多,相应的核内质子数也多,静电作用力增强影响原子的半径,电子层数多少只是影响原子半径的因素之一,原子电子层数越多,对应的原子半径不一定大,如K比I少一电子层,但半径K比I大,故A错误;
B、37号元素为铷,处于第IA族第五周期,故B正确;C、同族元素相差的原子序数可能为2、8、18、32,不可能相差36、46,故B错误;
D、氟元素是最活泼的非金属元素,无正价,故D错误,故选:B.
点评 本题考查元素周期律的应用,为高频考点,把握元素的位置、元素的性质及元素周期律为解答的关键,注意周期性的理解,题目难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
8.在下列各变化过程中,一定要加还原剂才能实现的是( )
| A. | HNO3→NO | B. | H2S→S | C. | FeCl2→FeCl3 | D. | SO32-→SO2 |
10.下列物质中不能发生银镜反应的是( )
| A. | 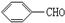 | B. | HCOOH | C. | HCOOC2H5 | D. | 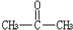 |
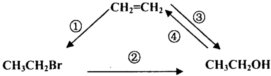
 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.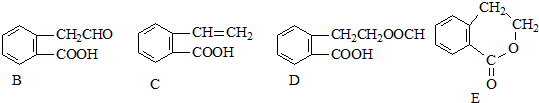
 .由A生成C的反应类型为消去反应.
.由A生成C的反应类型为消去反应.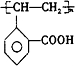 .
.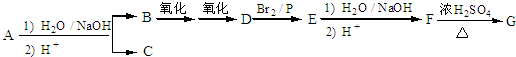
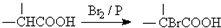
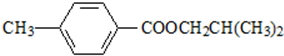 .
.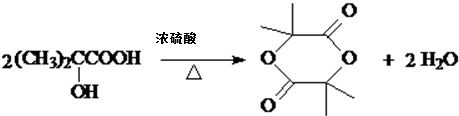 ,该反应属于取代反应(或酯化反应) (填反应类型).
,该反应属于取代反应(或酯化反应) (填反应类型).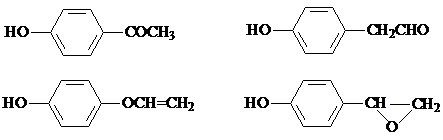 .
.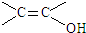 )结构.
)结构.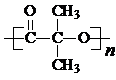 .
. 按要求书写:
按要求书写: ;-CH3
;-CH3

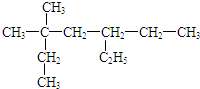 系统命名法的名称3,3-二甲基-5-乙基庚烷
系统命名法的名称3,3-二甲基-5-乙基庚烷