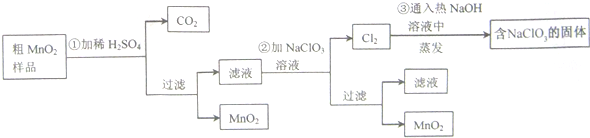
题目内容
8.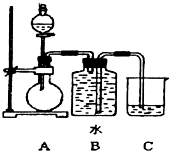 如图装置可以用来制取某些气体.
如图装置可以用来制取某些气体.(1)该装置可以制备乙炔气体,圆底烧瓶中盛放的物质是
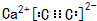 (填电子式)分液漏斗中盛放的是饱和食盐水,目的是使反应产生乙炔的速率平缓.
(填电子式)分液漏斗中盛放的是饱和食盐水,目的是使反应产生乙炔的速率平缓.(2)实验室中制备乙炔的反应原理是CaC2+2H2O→Ca(OH)2+C2H2↑,.
(3)用此方法制取的乙炔气体通常混有H2S气体,如何除去?CuSO4溶液(填化学试剂)
(4)还能用该装置制备和收集的气体有(答出任意一种即可)H2或O2.
(5)若用来制备乙烯气体,需要对装置进行改进,将分液漏斗改成温度计,温度计的水银球放置的位置是插入液面下,改进时还需要的玻璃仪器是酒精灯.
分析 (1)实验室常用块状固体碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔制备乙炔据此结合装置进行解答;
(2)实验室中制备乙炔的反应原理块状固体碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔;
(3)制取的乙炔气体通常混有H2S气体,通过硫酸铜溶液除去;
(4)根据该装置为固体和液体反应不需要加热的反应,生成的气体可用排水法收集,据此解答;
(5)用乙醇制取乙烯时的温度计,因测量的溶液的温度,需将温度计的下端插入液面以下;加热还需酒精灯;乙醇在浓硫酸加热170℃发生消去反应.
解答 解:(1)制取乙炔反应为固体和液体不需加热的反应,实验室常用块状固体碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔反应为:CaC2+2H2O→Ca(OH)2+C2H2↑,分液漏斗装的是液体药品,所以圆底烧瓶中盛放的物质是固体CaC2,属于离子化合物,电子式为: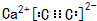 ,分液漏斗中盛放饱和食盐水减弱反应的剧烈程度,使反应产生乙炔的速率平缓,
,分液漏斗中盛放饱和食盐水减弱反应的剧烈程度,使反应产生乙炔的速率平缓,
故答案为: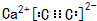 ;饱和食盐水;使反应产生乙炔的速率平缓;
;饱和食盐水;使反应产生乙炔的速率平缓;
(2)实验室中制备乙炔的反应原理块状固体碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(3)制取的乙炔气体通常混有H2S气体,通过硫酸铜溶液除去,CuSO4+H2S=CuS↓+H2SO4,故答案为:CuSO4溶液;
(4)该装置为固体和液体不需要加热的反应,分液漏斗装的是液体药品,可以通过控制分液漏斗滴加液体速率,来控制反应的速度,生成的气体难溶于水,可用排水法收集,实验室用过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,生成的氧气难溶于水,可用该装置;实验室用锌粒与稀硫酸反应制备氢气,Zn+H2SO4=ZnSO4+H2↑,生成的氢气难溶于水,可用该装置;
故答案为:O2或H2;
(5)乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,因需测量溶液的温度,用乙醇制取乙烯时的温度计下端需插入液面以下,加热还需酒精灯,
故答案为:插入液面下;酒精灯.
点评 本考点主要考查气体的制取装置和收集装置的选择,注意气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | C2H5OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O | |
| B. | CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O | |
| C. | CH3-CH=CH2+Br2→CH3-CHBr-CH2Br | |
| D. |  +Br2 $\stackrel{Fe}{→}$ +Br2 $\stackrel{Fe}{→}$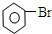 +HBr +HBr |
①新制氯水久置后→浅绿色褪去
②淀粉溶液遇单质碘→蓝色
③蔗糖中加入浓硫酸搅拌→白色
④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色.
| A. | ①②③④ | B. | ①②④⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
| A. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| C. | 在同一条件下,不同物质有不同的焓值,其体系的混乱程度越大,焓值越大 | |
| D. | AgCl在浓度相同的MgCl2溶液和KCl溶液中的溶解度相同 |
| A. | 苯酚与浓溴水反应生成三溴苯酚 | B. | 苯酚能和NaOH溶液反应 | ||
| C. | 苯酚燃烧产生带浓烟的火焰 | D. | 甲苯能使酸性高锰酸钾溶液褪色 |
(2)在80℃时,将0.40mol N2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②改变条件使反应重新达到平衡,能使$\frac{c(N{O}_{2})}{c({N}_{2}{O}_{4})}$值变小的措施有(填序号)A.
A.增大N2O4的起始浓度 B.升高温度 C.使用高效催化剂 D.向混合气体中通入稀有气体.