题目内容
3.关于方程:3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O下列叙述正确的是( )| A. | 当有12.8gCu参加反应,转移的电子数为0.4NA个 | |
| B. | 还原剂是Cu,还原产物是Cu(NO3)2 | |
| C. | 反应中HNO3既表现为酸性又表现为还原性 | |
| D. | Cu(NO3)2既是氧化产物又是还原产物 |
分析 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,硝酸反应生成硝酸盐时表现出酸性,然后利用化合价的变化来分析转移的电子数.
解答 解:A、由反应可知,当消耗1mol铜转移2mol电子,则当有12.8gCu参加反应,转移的电子数为$\frac{12.8}{64}$×2=0.4NA个,故A正确;
B、由反应可知,Cu元素从0价升高到+2价,则还原剂是Cu,生成为Cu(NO3)2氧化产物,N元素的化合价降低,生成NO为还原产物,故B错误;
C、因部分硝酸反应生成硝酸盐时表现出酸性,所以HNO3作氧化剂和酸性,故C错误;
D、Cu元素从0价升高到+2价,则还原剂是Cu,生成为Cu(NO3)2氧化产物,N元素的化合价降低,生成NO为还原产物,故D错误;
故选A.
点评 本题考查氧化还原反应,明确硝酸中氮元素的化合价变化是解答本题的关键和难点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.16g的某元素含有6.02×1023个原子,则该元素原子的相对原子质量为( )
| A. | 1 | B. | 12 | C. | 16 | D. | 23 |
14.已知1mol燃料完全燃烧的数据分别为:
使用上述燃料.最能体现“低碳经济”理念的是( )
| 燃料 | 一氧化碳 | 甲烷 | 异辛烷(C8H18) | 乙醇 |
| △H | -283.0kJ•mol-1 | -891.0kJ•mol-1 | -5461.0kJ•mol-1 | -1366.8kJ•mol-1 |
| A. | 一氧化碳 | B. | 甲烷 | C. | 异辛烷 | D. | 乙醇 |
11.常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应.上述两种方法都可制得的氯化物是( )
| A. | CuCl2 | B. | ZnCl2 | C. | FeCl3 | D. | AlCl3 |
18.下列反应中,属于加成反应的是( )
| A. | C2H5OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O | |
| B. | CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O | |
| C. | CH3-CH=CH2+Br2→CH3-CHBr-CH2Br | |
| D. | 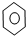 +Br2 $\stackrel{Fe}{→}$ +Br2 $\stackrel{Fe}{→}$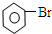 +HBr +HBr |
8.在下列各变化过程中,一定要加还原剂才能实现的是( )
| A. | HNO3→NO | B. | H2S→S | C. | FeCl2→FeCl3 | D. | SO32-→SO2 |
15.下列关于摩尔的说法中,正确的是( )
| A. | 是物质的量 | B. | 是一个物理量 | ||
| C. | 是一种物理量的单位 | D. | 是摩尔质量 |
