题目内容
6.如图所示是Zn和Cu形成的原电池,说法正确的是( )
| A. | 铜为负极,锌为正极 | B. | 正极反应为Zn-2e-=Zn2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 原电池的反映本质是氧化还原反应 |
分析 A、原电池活泼金属作负极,不活泼的为正极;
B、正极为铜表面氢离子得到电子生成氢气;
C、原电池电子由负极流向正极;
D、原电池反应是自发进行的氧化还原反应.
解答 解:A、原电池泼金属作负极,不活泼的为正极,则Cu为正极,Zn为负极,故A错误;
B、正极铜表面氢离子得到电子生成氢气,则正极反应为2H++2e-=H2↑,故B错误;
C、原电池电子由负极流向正极,所以由锌片通过导线流向铜片,故C错误;
D、原电池反应是自发进行的氧化还原反应,所以本质是氧化还原反应,故D正确;
故选D.
点评 本题考查原电池原理的分析应用,装置特征,电极名称、电极反应判断,题目较简单.

练习册系列答案
相关题目
11.下列设计的实验方案能达到实验目的是( )
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
17.下列有关说法正确的是( )
| A. | 白铁(镀锌铁皮)镀层破损后铁仍不易腐蚀 | |
| B. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)能自发进行,则该反应的△H>0 | |
| C. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) | |
| D. | 合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 |
14.某种碳酸饮料中主要含柠檬酸、碳酸、白砂糖、苯甲酸钠等成分,常温下测得其pH约为3.5,下列说法不正确的是( )
| A. | 常温下,该碳酸饮料中KW的值大于纯水中KW的值 | |
| B. | 该碳酸饮料中水的电离受到抑制 | |
| C. | 柠檬酸的电离会抑制碳酸的电离 | |
| D. | 打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度 |
1.实验室用NaOH固体和蒸馏水准确配置一定物质的量浓度的NaOH溶液,以下仪器不需要用到的是( )
| A. | 烧瓶 | B. | 烧杯 | C. | 容量瓶 | D. | 玻璃棒 |
11.下列有关硅及其化合物的用途及反应,正确的是( )
①二氧化硅可用来制造半导体器件
②硅可用于制造光导纤维
③2C+SiO2═高温═Si+2CO↑
④二氧化硅溶于水制硅酸.
①二氧化硅可用来制造半导体器件
②硅可用于制造光导纤维
③2C+SiO2═高温═Si+2CO↑
④二氧化硅溶于水制硅酸.
| A. | ③ | B. | ①②③ | C. | ③④ | D. | ②③④ |
18.下列说法正确的是( )
| A. | 碱金属的单质中,锂的还原性最强 | |
| B. | 第IA族元素比第IIA族元素的金属性强 | |
| C. | 同周期中,原子半径随原子序数的增大而减小(稀有气体除外) | |
| D. | 随着核电荷数的递增,第三周期元素的氧化物对应的水化物的酸性逐渐增强 |
15.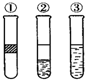 在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
 在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )| A. | ①是苯,②是CCl4,③是酒精 | B. | ①是酒精,②是CCl4,③是苯 | ||
| C. | ①是CCl4,②是苯,③是酒精 | D. | ①是苯,②是酒精,③是CCl4 |
16.许多有机物因溶解度、密度的不同可以用水来鉴别,下列各组有机物用水就可鉴别的是( )
| A. | C6H6,C6H14,CCl4 | B. | C6H6,C2H5OH,CCl4 | ||
| C. | C6H6,C2H5OH,CH3COOC2H5 | D. | C6H5NO2,C2H5OH,CH3COOH |