题目内容
A、B、C、D、E、F为原子序数递增的六种短周期元素;已知:A、B、C、D是组成蛋白质的基本元素;E和D可形成离子个数比均为2:1的两种化合物,F是地壳中含量最多的金属元素.
(1)写出B在周期表位置: ;D与E形成原子个数为1:1的化合物电子式: ;
(2)A与C能形成原子个数比为4:2的分子,写出该分子的结构式: ;
(3)Se是人体必需的微量元素,与D同一主族,且比.D多2个电子层,则Se的原子序数为 ;它与同族第三周期元素的最高价氧化物对应水化物的酸性强弱比较(用化学式表示): ;
(4)用F单质作阳极,石墨作阴极,NaHCO3溶液作电解液,进行电解,阳极观察到现象有: ,用电极反应方程式解释其原因: .
(1)写出B在周期表位置:
(2)A与C能形成原子个数比为4:2的分子,写出该分子的结构式:
(3)Se是人体必需的微量元素,与D同一主族,且比.D多2个电子层,则Se的原子序数为
(4)用F单质作阳极,石墨作阴极,NaHCO3溶液作电解液,进行电解,阳极观察到现象有:
分析:A、B、C、D、E、F为原子序数递增的六种短周期元素;已知:A、B、C、D是组成蛋白质的基本元素,则A为H元素、B为碳元素、C为N元素、D为O元素;E和D可形成离子个数比均为2:1的两种化合物,则E为Na;F是地壳中含量最多的金属元素,则F为Al,据此解答.
解答:解:A、B、C、D、E、F为原子序数递增的六种短周期元素;已知:A、B、C、D是组成蛋白质的基本元素,则A为H元素、B为碳元素、C为N元素、D为O元素;E和D可形成离子个数比均为2:1的两种化合物,则E为Na;F是地壳中含量最多的金属元素,则F为Al,
(1)B为碳元素,处于第二周期第ⅣA族,D与E形成原子个数为1:1的化合物为Na2O2,其电子式为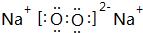 ,
,
故答案为:第二周期第ⅣA族; ;
;
(2)H与N能形成原子个数比为4:2的分子,该分子式为N2H4,分子中N原子之间形成1对共用电子对,每个N原子结合2个H原子,原子之间形成1对共用电子对,该分子的结构式为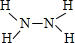 ,故答案为:
,故答案为: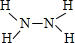 ;
;
(3)Se是人体必需的微量元素,与O同一主族,且比O多2个电子层,处于第四周期,则Se的原子序数=8+8+18=34;与Se同族第三周期元素为S,非金属性S>Se,故最高价含氧酸的酸性H2SO4>H2SeO4,
故答案为:34;H2SO4>H2SeO4;
(4)用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液,进行电解,阳极电极反应式:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+3CO2↑,故单质Al逐渐减少,有白色胶状沉淀生成并放出气泡,
故答案为:单质Al逐渐减少,有白色胶状沉淀生成并放出气泡;Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(1)B为碳元素,处于第二周期第ⅣA族,D与E形成原子个数为1:1的化合物为Na2O2,其电子式为
 ,
,故答案为:第二周期第ⅣA族;
 ;
;(2)H与N能形成原子个数比为4:2的分子,该分子式为N2H4,分子中N原子之间形成1对共用电子对,每个N原子结合2个H原子,原子之间形成1对共用电子对,该分子的结构式为
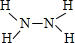 ,故答案为:
,故答案为: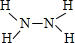 ;
;(3)Se是人体必需的微量元素,与O同一主族,且比O多2个电子层,处于第四周期,则Se的原子序数=8+8+18=34;与Se同族第三周期元素为S,非金属性S>Se,故最高价含氧酸的酸性H2SO4>H2SeO4,
故答案为:34;H2SO4>H2SeO4;
(4)用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液,进行电解,阳极电极反应式:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+3CO2↑,故单质Al逐渐减少,有白色胶状沉淀生成并放出气泡,
故答案为:单质Al逐渐减少,有白色胶状沉淀生成并放出气泡;Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评:本题考查结构性质位置关系应用,难度中等,(4)为易错点、难点,学生容易忽略铝离子与碳酸氢根离子发生双水解反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.