题目内容
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某体学研究小组的同学分别设计了图甲、乙所示的实验。请回答相关问题:

(1)定性比较:图甲可通过观察_____,定性比较得出结论。有同学提出将CuSO4改为CuCl2更合理一些,其理由是______。
(2)定量比较:如图乙所示,实验时均以生成40 mL气体为标准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是________,实验中需要测量的数据是_______。
(3)将0.10 mol MnO2粉末加入到50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
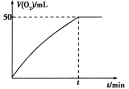
①写出H2O2在MnO2作用下发生反应的化学方程式:_______。
②H2O2的初始物质的量浓度为________。(保留两位有效数字)
【答案】单位时间内产生气泡的快慢 消除阴离子不同对实验的干扰 关闭分液漏斗活塞,注射器中活塞向右拉,一段时间后,松开手,观察活塞回复到原来的位置,说明气密性良好 产生40mL气体所需的时间 2H2O2![]() 2H2O+O2↑ 0.088mol/L
2H2O+O2↑ 0.088mol/L
【解析】
过氧化氢分解会放出氧气,比较反应速率的大小可通过生成气泡的快慢来判断,比较金属阳离子的催化效果要排除阴离子的干扰;若需要测量化学反应速率,则根据化学反应速率公式v=![]() 计算;结合图像所给数据计算过氧化氢浓度。
计算;结合图像所给数据计算过氧化氢浓度。
(1)定性比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过观察产生气泡的快慢来比较,产生气泡快的,催化效果好;在探究Fe3+和Cu2+对H2O2分解的催化效果时,必须保持其他的条件完全相同,所以将CuSO4改为CuCl2更为合理,可以避免由于阴离子不同造成的干扰;
(2)检查装置气密性的方法为:关闭分液漏斗活塞,注射器中活塞向右拉,一段时间后,松开手,观察活塞回复到原来的位置,说明气密性良好;定量比较Cu2+和Fe3+对H2O2分解的催化效果,可以通过测定产生40mL气体所需要的时间来比较,产生40mL气体的时间越短,催化效果越好;
(3)①过氧化氢在二氧化锰的作用下分解生成水和氧气,反应方程式为2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
②t时刻产生50mL氧气,则这50mL氧气在标准状况下的物质的量为n(O2)=![]() =2.2×10-3mol,根据过氧化氢分解的方程式可以得到n(H2O2)=4.4×10-3mol,则过氧化氢初始浓度c=
=2.2×10-3mol,根据过氧化氢分解的方程式可以得到n(H2O2)=4.4×10-3mol,则过氧化氢初始浓度c=![]() =
=![]() =0.088mol/L。
=0.088mol/L。

【题目】根据工业上合成氨的反应为:![]() ,判断下列错误的是
,判断下列错误的是
A | B | C | D |
|
|
|
|
根据图中a点数据计算 | 表示从通入原料开始,随温度不断升高, | 向绝热恒容器中通入 | 图中 |
A.AB.BC.CD.D
【题目】已知:N2(g)+3H2(g)===2NH3(g) △H=-92kJ/mol。起始反应物为![]() 和
和![]() ,物质的量之比为1:3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中
,物质的量之比为1:3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中![]() 的物质的量分数如下表:
的物质的量分数如下表:
温度 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中![]() 的物质的量分数越大,则正反应速率越大
的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时, ![]() 和
和![]() 的转化率均为1
的转化率均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成![]() 的物质的量最多
的物质的量最多