题目内容
【题目】铁、铝是生活中重要的金属材料,铁铝及其化合物有非常重要的用途。
(1)下列说法不正确的是__________(填序号)。
①配制FeCl3、ACl3溶液时,均是先将固体FeCl3、ACl3溶于较浓的盐酸,再用蒸馏水稀释到所需浓度
②FeCl2、FeCl3、Fe(OH)3均可以通过化合反应生成
③利用氯水和KSCN溶液可以检验FeCl3溶液中有无Fe2+
④加热蒸干Al2(SO4)3溶液残留固体的成分为Al2O3
(2)以高碗铝土矿(主要成分为Al2O3、Fe2O3、SiO2、少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

①流程中两次焙烧均会产生SO2,用NaOH溶液吸收处理SO2的离子方程式为___________。
②添加1%CaO和不添加CaO的矿粉焙烧其硫去除率随温度变化曲线如图所示。

已知:多数硫酸盐的分解温度都高于600℃
硫去除率=(1-![]() )×100%
)×100%
I.不添加CaO的矿粉在低于500℃焙烧时,去除的硫元素主要来源于__________。
Ⅱ.700℃时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是___________________。
③“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,写出该反应的化学方程式___________________。
(3)已知25℃时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1mo·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成__________(填化学式)沉淀。
②溶液中某离子浓度低于1.0×10-5ml·L-1时,可以认为已沉淀完全。现向一定浓度的AlCl3和FeCl3混合溶液中逐滴加入氨水,当Fe3+恰好沉淀完全时,测得c(Al3+)=0.2mol·L-1,所得沉淀中__________(选填“还含有”或“不含有”)Al(OH)3。理由是___________________(通过计算说明)。
【答案】③④ SO2![]() 2OH-=SO32-
2OH-=SO32-![]() H2O 或SO2
H2O 或SO2![]() OH-=HSO3- FeS2 S转化成了CaSO4,留在矿粉中 FeS
OH-=HSO3- FeS2 S转化成了CaSO4,留在矿粉中 FeS![]() 16Fe2O3
16Fe2O3![]() 11Fe3O4
11Fe3O4![]() 2SO2
2SO2![]() Al(OH)3 不含有 Fe3+完全沉淀时,c(Al3+)·c3(OH-)
Al(OH)3 不含有 Fe3+完全沉淀时,c(Al3+)·c3(OH-)![]() Ksp[Al(OH)3]
Ksp[Al(OH)3]
【解析】
(1)依据实验中所涉及的各物质的性质分析;
(2)①NaOH和SO2反应,生成Na2SO3和H2O或NaHSO3;
②I.由题给已知条件,多数金属硫酸盐的分解温度,高于600![]() ,不添加CaO的矿粉低于 500
,不添加CaO的矿粉低于 500![]() 焙烧时去除的S元素,主要来自于FeS2,Ⅱ.700℃时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是生成了CaSO4;
焙烧时去除的S元素,主要来自于FeS2,Ⅱ.700℃时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是生成了CaSO4;
③Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2;
(3)①物质的溶度积越小,越易形成沉淀;
②根据溶度积常数计算并解答;
(1)①配制FeCl3、AlCl3溶液时,先将固体FeCl3、AlCl3溶于较浓的盐酸,防止Fe3+、Al3+水解,再用蒸馏水稀释到所需浓度,故①正确;
②FeCl2、FeCl3、Fe(OH)3均可以通过化合反应生成,例如:2FeCl3![]() Fe=3FeCl2、2Fe
Fe=3FeCl2、2Fe![]() 3Cl2=3FeCl2、4Fe(OH)2
3Cl2=3FeCl2、4Fe(OH)2![]() O2
O2![]() 2H2O=4Fe(OH)3,故②正确;
2H2O=4Fe(OH)3,故②正确;
③因为Fe3+遇KSCN溶液变成血红色溶液,所以不能用可以氯水和KSCN溶液可以检验FeCl3溶液中有无Fe2+,故③错误;
④加热蒸干Al2(SO4)3溶液虽然Al3水解,但硫酸是难挥发性酸,所以残留固体的成分仍为Al2(SO4)3,故④错误;本题答案为:③④。
(2)①NaOH和SO2反应,生成Na2SO3和H2O,离子方程式为:SO2![]() 2OH-=SO32-
2OH-=SO32-![]() H2O 或SO2
H2O 或SO2![]() OH-=HSO3-;本题答案为:SO2
OH-=HSO3-;本题答案为:SO2![]() 2OH-=SO32-
2OH-=SO32-![]() H2O 或SO2
H2O 或SO2![]() OH-=HSO3-。
OH-=HSO3-。
②I.由题给已知条件,多数金属硫酸盐的分解温度,高于600![]() ,不添加CaO的矿粉低于 500
,不添加CaO的矿粉低于 500![]() 焙烧时去除的S元素,主要来自于FeS2,Ⅱ.700℃时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是生成了CaSO4,留在矿粉中;
焙烧时去除的S元素,主要来自于FeS2,Ⅱ.700℃时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是生成了CaSO4,留在矿粉中;
本题答案为:FeS2,S转化成了CaSO4,留在矿粉中。
③Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,化学方程式为:FeS![]() 16Fe2O3
16Fe2O3![]() 11Fe3O4
11Fe3O4![]() 2SO2;本题答案为:FeS
2SO2;本题答案为:FeS![]() 16Fe2O3
16Fe2O3![]() 11Fe3O4
11Fe3O4![]() 2SO2
2SO2![]() 。
。
(3)①根据Al(OH)3、Cu(OH)2的溶度积常数,在25![]() 下,向浓度均为0.1mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,由于
下,向浓度均为0.1mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,由于![]() ,加入相同的浓度的氨水,Al(OH)3最先析出,本题答案为:Al(OH)3。
,加入相同的浓度的氨水,Al(OH)3最先析出,本题答案为:Al(OH)3。
②Fe3+完全沉淀时,c3(OH-)=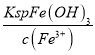 =
=![]() =4.0
=4.0![]() ,c(Al3+)·c(OH-)=0.2
,c(Al3+)·c(OH-)=0.2![]() =8
=8![]() KspAl(OH)3,所以没有生成Al(OH)3沉淀,故此时所得沉淀不含有Al(OH)3;本题答案为;不含有,Fe3+完全沉淀时,c(Al3+)·c3(OH-)
KspAl(OH)3,所以没有生成Al(OH)3沉淀,故此时所得沉淀不含有Al(OH)3;本题答案为;不含有,Fe3+完全沉淀时,c(Al3+)·c3(OH-)![]() Ksp[Al(OH)3]。
Ksp[Al(OH)3]。

【题目】下列解释实验事实的化学用语不正确的是( )
实验 | 解释 | |
A | 25℃0.1mol/L盐酸溶液pH=1 | H2O=H++OH- |
B | 25℃0.1mol/L的NH3·H2OpH=11 | NH3·H2O |
C | 配制FeCl3溶液时加少量盐酸 | Fe3++3H2O |
D | 向0.1mol/LNa2CO3溶液中滴加酚酞试液后溶液变红 | CO32-+H2O |
A.AB.BC.CD.D