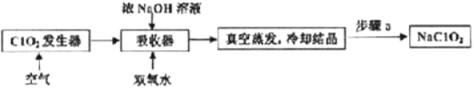
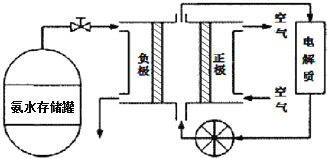
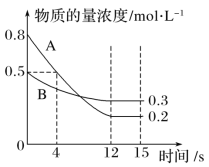
题目内容
【题目】298K时,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物质的量分数δ(X),δ(X)随pH的变化如图所示。下列叙述错误的是( )

A.Ka2(H3PO4)的数量级为10-8
B.Kh(HPO42-)=1.0×10-6.8
C.pH=7时c(H2PO4-)>c(HPO42-)
D.NaH2PO4溶液显碱性
【答案】D
【解析】
此题解题所需的信息都在图中,所以解答各选项时,应从图中选择合适的点,然后提取数据进行分析。
A. 选择pH=6的点,此时δ(H2PO4-)=0.95,δ(HPO42-)=0.05,Ka2(H3PO4)=![]() ,数量级为10-8,A正确;
,数量级为10-8,A正确;
B. 选择pH=7.5的点,此时δ(H2PO4-)=0.33,δ(HPO42-)=0.67,Kh(HPO42-)=![]() =1.0×10-6.8,B正确;
=1.0×10-6.8,B正确;
C. pH=7时,δ(H2PO4-)=0.65,δ(HPO42-)=0.35,c(H2PO4-)>c(HPO42-),C正确;
D. NaH2PO4溶液中,H2PO4-的电离程度小,c(H2PO4-)>c(HPO42-),从图中可以看出, pH<7时,溶液显酸性,D错误;
故选D。

【题目】二甲胺是农药螟铃畏的重要中间体,在一定温度压强及催化剂条件下由氨与甲醇作用而制得,反应原理为:2CH3OH(g)+NH3(g)CH3NHCH3(g)+2H2O(g)
已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
②2NH3(g)+![]() O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
③CH3NHCH3(g)+![]() O2(g)=2CO2(g)+
O2(g)=2CO2(g)+![]() H2O(g)+
H2O(g)+![]() N2(g) ΔH=-1872.6 kJ·mol-1
N2(g) ΔH=-1872.6 kJ·mol-1
(1)写出CH3OH(g)与NH3(g)转化为CH3NHCH3(g)和H2O(g)的热化学方程式是____________。
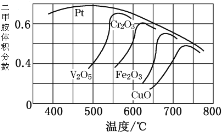
(2)不同的催化剂对二甲胺合成催化效率不同(如图所示),则最合适的催化剂及温度是_____________
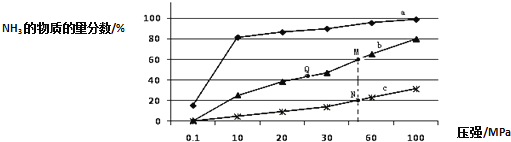
(3)一定条件下,原料气中n(CH3OH)/n(NH3)比值和温度对NH3平衡转化率影响的实验数据如图:
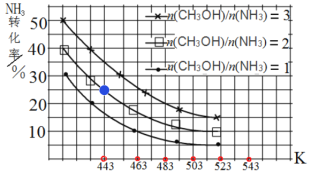
①温度为443 K时,在1 L反应容器中投入4 mol NH3和8 mol CH3OH进行反应,试计算达到平衡时CH3NHCH3(g)浓度为_________molL-1,该温度下化学平衡常数为_____________
②结合图中数据,归纳 NH3平衡转化率受外界条件影响的变化规律:a:_______b:________
(4)二甲胺水溶液类似于氨水,呈碱性;则二甲胺在水中的电离方程式为__________
(5)常温下,将二甲胺和盐酸等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验编号 | 二甲胺浓度(mol.L-1) | 盐酸浓度(mol.L-1) | 混合后溶液的PH |
甲 | 0.1 | 0.1 | a |
乙 | 0.15 | 0.1 | 8 |
丙 | 0.2 | 0.1 | 10 |
①实验甲中,a______(填“大于”、“小于”或“等于”)7
②实验丙混合后的溶液中离子浓度大小关系为______________