题目内容
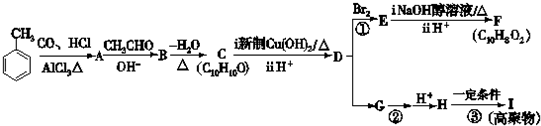
7.图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物.
根据图回答问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,C分子中的官能团名称是羧基;化合物B不能发生的反应是(填字母序号):e
a.加成反应b.取代反应c.消去反应
d.酯化反应e.水解反应f.置换反应
(2)反应②的化学方程式是CH3COOH+CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH3+H2O.
(3)反应②实验中加热的目的是:加快反应速率;及时将产物乙酸丙酯蒸出,以利于平衡向生成乙酸丙酯的方向移动..
(4)A的结构简式是
 .
.(5)写出同时符合下列三个条件的B的同分异构体所有同分异构体的结构简式.
Ⅰ.含有间二取代苯环结构Ⅱ.不属于芳香酸形成的酯
Ⅲ.与 FeCl3溶液发生显色反应
 .
.
分析 E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,则碳、氢、氧的原子个数比=$\frac{58.8%}{12}$:$\frac{9.8%}{1}$:$\frac{1-58.8%-9.8%}{16}$=5:10:2,则E的分子式为C5H10O2;E为无支链的化合物,并且含有5个C原子,由C和D反应生成,C能和碳酸氢钠反应,则C为羧酸,D为醇,二者共含5个C原子,并且C和D的相对分子质量相等,应为乙酸和丙醇,E无支链,D应为1-丙醇,二者发生酯化反应生成酯E;A是由B与乙酸、丙醇发生酯化反应后生成的产物,其结构简式为: ,据此答题;
,据此答题;
解答 解:E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,则碳、氢、氧的原子个数比=$\frac{58.8%}{12}$:$\frac{9.8%}{1}$:$\frac{1-58.8%-9.8%}{16}$=5:10:2,则E的分子式为C5H10O2;E为无支链的化合物,并且含有5个C原子,由C和D反应生成,C能和碳酸氢钠反应,则C为羧酸,D为醇,二者共含5个C原子,并且C和D的相对分子质量相等,应为乙酸和丙醇,E无支链,D应为1-丙醇,二者发生酯化反应生成酯E;A是由B与乙酸、丙醇发生酯化反应后生成的产物,其结构简式为: ,
,
(1)通过以上分析知,C是乙酸,所以C含有羧基,B中含有羧基、醇羟基和苯环,且连接醇羟基碳原子相邻的碳原子上有氢离子,所以B能发生加成、取代、酯化、消去、置换等反应,不能发生水解反应;
故答案为:羧基;e;
(2)②为乙酸和丙醇的酯化反应,反应方程式为:CH3COOH+CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH3+H2O,
故答案为:CH3COOH+CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH3+H2O;
(3)该反应较缓慢,为加快反应速率,所以加热,且加热能及时将产物乙酸丙酯蒸出,有利于平衡向正反应方向移动,所以反应②实验中加热,
故答案为:加快反应速率;及时将产物乙酸丙酯蒸出,以利于平衡向生成乙酸丙酯的方向移动;
(4)通过以上分析知,A的结构简式为 ;
;
(5)符合条件的B的同分异构体中,含有两个取代基、其中一个是羟基,并且是由乙酸、丙酸或甲酸分别与对应的芳香醇或酚酯化反应生成的酯类物质,可判断出符合条件的有4种,分别为 ,
,
故答案为: .
.
点评 本题考查有机物的合成与推断,并考查盐类的水解等知识,结合反应条件与转化判断其结构是解题的关键,做该类型题目时注意挖掘题目中的关键信息,采用正推或逆推的方式逐一突破,难度较大.

 名校课堂系列答案
名校课堂系列答案| A. | 分子中N-C-N键角为90° | |
| B. | C(N3)4中碳元素为正价,C(N3)4分子中存在极性键和非极性键 | |
| C. | C(N3)4就是石墨吸附N2后所得的物质 | |
| D. | 该物质为分子晶体,每18g C(N3)4完全分解可产生13.44L的气体 |
| A. | ClO2的分子结构呈V型,属非极性分子 | |
| B. | ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子的数目表示)是Cl2的5倍 | |
| C. | ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害 | |
| D. | 常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O |
| A. | 将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照 | |
| B. | 不能使无色酚酞试液变色的溶液是酸性溶液 | |
| C. | 可以用紫色石蕊试液作为强酸滴定强碱的指示剂 | |
| D. | 用pH试纸测定某溶液的pH=8.5,此溶液一定是某种碱的溶液 |
| A. | 在此反应中硝酸体现强氧化性,全部被还原 | |
| B. | 向反应后的溶液中再加入金属铁,不再发生化学反应 | |
| C. | 该反应中被还原的硝酸与未被还原的硝酸之比为1:4 | |
| D. | 该反应中被还原的硝酸与未被还原的硝酸之比为1:5 |
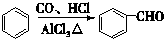
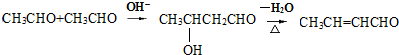
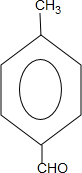 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +nH2O.
+nH2O. .
.