题目内容
17.(1)在同温同压下,相等质量的氧气和臭氧,它们的物质的量之比为3:2,分子个数比为3:2,原子个数比为1:1(2)在一密闭容器中充入a mol NO 和b mol O2,可发生如下反应:2NO+O2═2NO2,充分反应后容器中氮原子和氧原子的个数之比为a:(a+2b).
分析 (1)氧气和臭氧都是有氧元素构成,根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合分子构成计算;
(2)根据反应前后原子的数目不变计算.
解答 解:(1)设氧气和臭氧的质量都为mg,则:二者的物质的量之比为n(O2):n(O3)=$\frac{mg}{32g/mol}$:$\frac{mg}{48g/mol}$=3:2,
根据N=nNA可知,二者的分子数之比与物质的量成正比,则N(O2):N(O3)=3NA:2NA=3:2,
由于都由O原子组成,则质量相同时O原子个数相同,比值为1:1,
故答案为:3:2;3:2;1:1;
(2)反应前后原子的数目、质量不变,a mol NO和b mol O2,充分反应后容器中氮原子和氧原子的个数之比为a:(a+2b),
故答案为:a:(a+2b).
点评 本题考查阿伏伽德罗定律及其推论,为高频考点,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用.

练习册系列答案
相关题目
7.对于某一已经建立平衡的可逆反应,当条件改变或采取某项措施时使平衡向正反应方向移动,以下叙述中正确的是( )
①生成物的质量分数一定增大
②生成物的产量一定增加
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥一定使用催化剂.
①生成物的质量分数一定增大
②生成物的产量一定增加
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥一定使用催化剂.
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ②⑤ |
8.下列有关钠的叙述中,错误的是( )
| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 电解熔融氯化钠时,钠离子被还原为钠 | |
| C. | 钠是一种灰黑色的固体 | |
| D. | 钠的质地软,熔点低于100℃ |
5.标准状况下,将NO2和O2按4:1体积比充满一烧瓶,烧瓶倒置于水中待液面稳定(假设溶质不向外扩散),则烧瓶内溶液的物质的量浓度为(mol/L)( )
| A. | 1 | B. | 0.8 | C. | $\frac{1}{22.4}$ | D. | $\frac{1}{28}$ |
2.下列关于反应热的说法不正确的是( )
| A. | 已知下列热化学方程式:2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1,则氢气的燃烧热为242kJ•mol-1 | |
| B. | 中和反应的实质是H+ 与OH-结合生成水,若有其它物质生成,这部分反应热不在中和热内 | |
| C. | 物质的燃烧热可利用仪器由实验测得 | |
| D. | 中和热不包括物质溶解、电离、水合等过程中的热效应 |
9.下列物质中,一定能使KMnO4酸性溶液和溴水都因发生化学反应而褪色的是( )
| A. |  | B. |  | C. |  | D. | C6H12 |

 .
.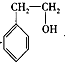 +CH3COOH$?_{△}^{浓硫酸}$
+CH3COOH$?_{△}^{浓硫酸}$ +H2O.
+H2O. 、、
、、 、
、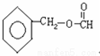 .
.
 .
. .
.