题目内容
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl22CO2H2O
(1)X基态原子的电子排布式为______.
(2)C、H、O三种原子的电负性由大到小的顺序为______.
(3)X2Cl22CO2H2O是一种配合物,其结构如图1所示:
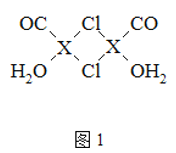
①与CO为互为等电子体的分子是______.
②该配合物中氯原子的杂化方式为______.
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键______.
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为______.XCl的化学式__________
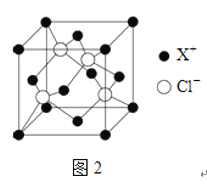
已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加德罗常数NA=_____________(无需化简,列式即可)。
【答案】1s22s22p63s23p63d104s1或[Ar]3d104s1 O>C>H N2 sp3 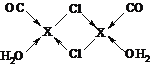 4 CuCl
4 CuCl 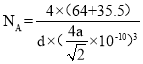
【解析】
元素X的基态原子中的电子共有7个能级,说明有四个电子层,且最外层电子数为1,X原子的内层轨道全部排满电子说明3d轨道排满,即为Cu[Ar]3d104s1,根据等电子的概念寻找CO的等电子体,根据杂化轨道理论判断杂化方式,结合均摊法进行晶胞的计算。
(1)根据上述分析可知,X为Cu,基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)同周期,从左到右,电负性逐渐增大,即O>C,非金属性越强,电负性越强,所以C>H,即O>C>H,故答案为:O>C>H;
(3)X2Cl2·2CO·2H2O是一种配合物,①等电子体原子总数相同,价电子总数相同,因此可以找与这些原子相邻的原子,则CO互为等电子体的分子是N2,故答案为:N2;
②由分子结构示意图可知,每个氯原子形成2个σ键,还有两对孤对电子,因此氯原子的杂化方式为sp3,故答案为:sp3;
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,CO、H2O、Cl-各提供孤对电子,亚铜离子提供空轨道,因此配位键图示为 ,故答案为:
,故答案为: ;
;
(4)CuCl的晶胞如图2所示,以面心分析,左边两个Cl-,右边两个Cl-,即距离每个Cu+最近的Cl-的个数为4,有晶胞示意图可知,Cu+位于晶胞的顶点和面上,则1个晶胞中含有的Cu+的个数为![]() ,Cl-位于晶胞的体内,则1个晶胞中含有的Cl-的个数为4×1=4,则XCl的化学式为CuCl,若Cu原子的半径为a pm,即每个边长为
,Cl-位于晶胞的体内,则1个晶胞中含有的Cl-的个数为4×1=4,则XCl的化学式为CuCl,若Cu原子的半径为a pm,即每个边长为![]() pm,晶体的密度为dg/cm3,每个晶胞中有4个Cu+,4个Cl-,
pm,晶体的密度为dg/cm3,每个晶胞中有4个Cu+,4个Cl-,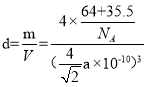 ,阿伏加德罗常数
,阿伏加德罗常数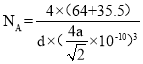 ,故答案为:4;CuCl;
,故答案为:4;CuCl;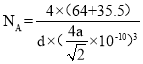 。
。

【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色晶体,常用作催化剂和陶瓷着色剂,为确定其组成,某小组进行了实验探究。
(查阅资料)碱式碳酸镍300℃以上时分解生成3种氧化物。NiO为绿色粉末,Ni2O3为灰黑色固体。
(实验探究)选用下图所示部分装置进行实验(夹持装置略)
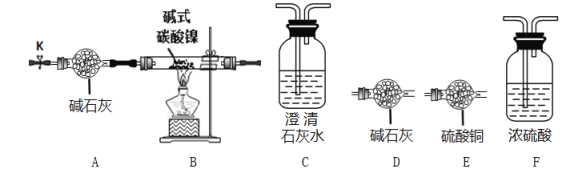
实验I定性探究:确定3种氧化物的组成。
(1)预测三种氧化物分别是含Ni、H、、C三种元素的理论依据是___________________。
(2)经检验生成的三种氧化物分别为NiO、H2O和CO2,装置连接顺序为AB__________(填装置的字母序号)。其中装置B现象为_________________。
实验II 定量确定碱式碳酸镍的组成。连接装置A-B-F-D-D进行实验。
实验步骤如下:
i 称量碱式碳酸镍、装置F、装置D(前一个)的质量并记录
ii 打开活塞K,缓缓通入空气
iii点燃酒精灯,加热
iv熄灭酒精灯, 冷却到室温, 关闭K
v 再次称量装置F、装置D(前一个)的质量并记录
(3)其中步骤ii的目的是_____________________________________。
(4)若缺少装置A将导致所测得的x值___________(填“偏大”或“偏小”或“无影响”)。
(5)重复操作ii-v至__________________________时,可判断碱式碳酸镍已完全分解。
(6)实验前测得石英玻璃管中的样品质量为3.77g,其他数据如下表所示
装置F质量/g | 装置D(前一个)质量/g | |
实验前 | 132.00 | 41.00 |
实验后 | 133.08 | 41.44 |
该碱式碳酸镍的化学式为____________________________________。
【题目】海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢就是抗腐蚀性能强的新型材料。
①基态Ni原子的电子排布式为________________,铬元素在周期表中____区。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有________ mol σ键。
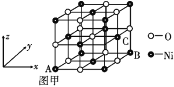
③NiO的晶体结构如图甲所示,其中离子坐标参数 A 为(0,0,0),B为(1,1,0),则C离子坐标参数为____。
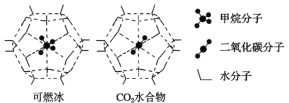
(2)海洋底部有储量丰富的可燃冰,一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与H2O的结合能 E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的2种作用力是_____________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知如图中笼状结构的空腔直径为0.586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________________。
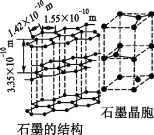
(3)①CH4和CO2所含的三种元素电负性从小到大的顺序为_______________
②碳的另一种同素异形体——石墨,其晶体结构如图所示,则石墨晶胞含碳原子个数为____个.已知石墨的密度为ρ g·cm—3,C—C键长为r cm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距为__________cm。