题目内容
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-a kJ/mol,则a__238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:____。
(3)反应mA(g)+nB(g)![]() pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
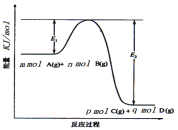
该反应ΔH=___(用含E1、E2式子表示);在反应体系中加入催化剂,E1__,E2__,(填增大、减小、不变)。
【答案】< 2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ/mol ΔH=-(E2-E1)kJ/mol 减小 减小
【解析】
(1)CH3OH(l)的燃烧热是1mol甲醇燃烧生成CO2(g)和H2O(l)放出的热。
(2)1mol Cl2参与反应时释放出145kJ热量,则2mol Cl2与2mol H2O(g)反应放热290 kJ;
(3)焓变=反应物的总键能-生成物的总键能;催化剂降低活化能;
(1)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,液态水为稳定的氧化物,1mol甲醇燃烧生成CO2(g)和H2O(l)放热238.6kJ,所以1mol甲醇燃烧生成CO2(g)和H2O(g),放出的热量小于燃烧热,故a<238.6;
(2)有1molCl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g) ΔH=-290kJ·mol1;
(3)由图象可知该反应是一个能量降低的反应,所以属于放热反应;ΔH=反应物的总键能-生成物的总键能,所以ΔH=E1-E2= -(E2-E1)kJ/mol;加入催化剂改变了反应的途径,降低反应的活化能,所以E1和E2都减小。

 名校课堂系列答案
名校课堂系列答案【题目】在一定条件,向一密闭容器中充入一定量CO2气体,并加入足量铁粉,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知该反应在不同温度下的平衡常数如下:
FeO(s)+CO(g),已知该反应在不同温度下的平衡常数如下:
T/℃ | 1200 | 1100 | 1000 | 900 | 800 |
K | 0.36 | 0.49 | 1.0 | 1.23 | 1.89 |
(1)该反应的化学平衡常数表达式为K=______。
(2)该反应为______(填“吸热”或“放热”)反应。
(3)能判断该反应是否达到化学平衡状态的依据是____。
A.容器中压强不变 B.混合气体中c(CO)不变
C.混合气体的平均相对分子质量不变 D.c(CO2)=c(CO)
(4)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是_____(填序号)。
A.温度 B.铁粉的量(足量)
C.压强 D.CO的量
(5)在900℃下,该反应达到平衡时,CO2的物质的量浓度为2mol·L-1,则此时c(CO)=____ mol·L-1