题目内容
【题目】现有三个热化学方程式:
(1)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A. -488.3 kJ/mol B. +488.3 kJ/mol
C. -2 228.9 kJ/mol D. +191 kJ/mol
【答案】A
【解析】已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
则根据盖斯定律可知②×2+③×2-①即得到反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为-488.3 kJ/mol,答案选A。

【题目】下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;V、VI是气体收集装置,根据要求回求答下列问题:
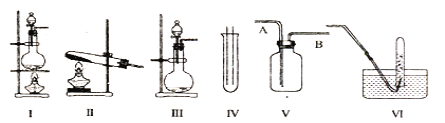
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择_________(填序号);若用I装置制取氯气,则浓盐酸应盛放在__________(填I中的仪器名称)。写出实验室制取氯气的化学方程式_________________________________________。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从__________口通入。
(3)实验室制取氯气,多余的氯气要进行尾气处理,一般将尾气通入到氢氧化钠溶液中,其发生反应的离子方程式为________________________________________。
(4)气体的吸收:若标准状况下1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为________mol/L。(保留一位小数)

(5)实验室用右图装置(夹持及加热仪器已略)制备氯气并进行一系列相关实验。
①装置B中饱和食盐水的作用是___________;
②设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为___________色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是溶液分为两层,下层为 ___________色
③装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入________。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
