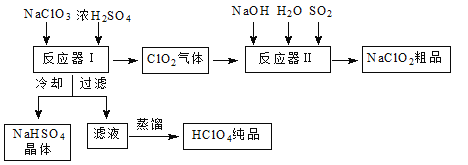
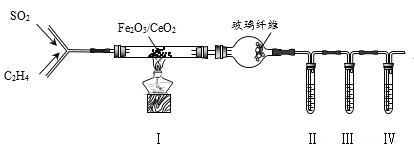
题目内容
【题目】在密闭容器中进行反应:X2(g)+3Y2(g)![]() 2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是( )
2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是( )
①X2为0.2 molL-1 ②Y2为0.1 molL-1 ③Z2为0.3 molL-1 ④Y2为0.6 molL-1
A. ①② B. ②③ C. ③④ D. ①④
【答案】B
【解析】
根据反应X2(g)+3Y2(g)2Z2(g)为可能反应,反应体系中的各组分浓度不可能为0,根据初始浓度分别为0.1molL-1、0.3molL-1、0.2molL-1,结合反应方程式中各物质的化学计量数进行判断。
由于该反应是可逆反应,则反应物或生成物的浓度不可能是0,①中X2为0.2 mol/L,则需要消耗0.2 mol/L的Z2 ,此时生成物Z的浓度0,不可能,故①错误;②Y2为0.1molL-1,反应消耗0.2 mol/L×![]() =
=![]() molX2,由于X2为0.1molL-1,有可能,故②正确;③Z2为0.3molL-1,需要消耗0.05molL-1X2、0.15mol/L的Y2,此时反应物的浓度都不为0,有可能,故③正确;④Y2为0.6molL-1,需要消耗0.2mol/L的Z2 ,此时生成物Z的浓度0,不可能,故④错误;答案选B。
molX2,由于X2为0.1molL-1,有可能,故②正确;③Z2为0.3molL-1,需要消耗0.05molL-1X2、0.15mol/L的Y2,此时反应物的浓度都不为0,有可能,故③正确;④Y2为0.6molL-1,需要消耗0.2mol/L的Z2 ,此时生成物Z的浓度0,不可能,故④错误;答案选B。

练习册系列答案
相关题目