题目内容
【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色晶体,常用作催化剂和陶瓷着色剂,为确定其组成,某小组进行了实验探究。
(查阅资料)碱式碳酸镍300℃以上时分解生成3种氧化物。NiO为绿色粉末,Ni2O3为灰黑色固体。
(实验探究)选用下图所示部分装置进行实验(夹持装置略)
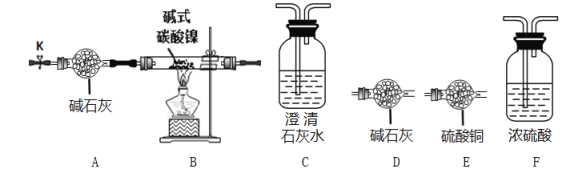
实验I定性探究:确定3种氧化物的组成。
(1)预测三种氧化物分别是含Ni、H、、C三种元素的理论依据是___________________。
(2)经检验生成的三种氧化物分别为NiO、H2O和CO2,装置连接顺序为AB__________(填装置的字母序号)。其中装置B现象为_________________。
实验II 定量确定碱式碳酸镍的组成。连接装置A-B-F-D-D进行实验。
实验步骤如下:
i 称量碱式碳酸镍、装置F、装置D(前一个)的质量并记录
ii 打开活塞K,缓缓通入空气
iii点燃酒精灯,加热
iv熄灭酒精灯, 冷却到室温, 关闭K
v 再次称量装置F、装置D(前一个)的质量并记录
(3)其中步骤ii的目的是_____________________________________。
(4)若缺少装置A将导致所测得的x值___________(填“偏大”或“偏小”或“无影响”)。
(5)重复操作ii-v至__________________________时,可判断碱式碳酸镍已完全分解。
(6)实验前测得石英玻璃管中的样品质量为3.77g,其他数据如下表所示
装置F质量/g | 装置D(前一个)质量/g | |
实验前 | 132.00 | 41.00 |
实验后 | 133.08 | 41.44 |
该碱式碳酸镍的化学式为____________________________________。
【答案】化学反应前后元素种类不变 EC 绿色晶体变成绿色粉末 防止水蒸气和二氧化碳的质量测量产生误差 偏小 装置F、装置D(前一个)的质量与前一次测量值相比不变时 Ni3(OH)4CO3·4H2O
【解析】
本题的实验目的为探究物质的组成,根据元素守恒,可确定三种氧化物为水、二氧化碳、和镍的氧化物验证先后顺序为先验证水,并除去水;再吸收二氧化碳,并验证是否吸收完全。确定碱式碳酸镍的组成,连接装置A-B-F-D-D进行实验;
(1)根据化学反应中原子守恒,可确定三种氧化为Ni、H、C的氧化物,答案为:化学反应前后元素种类不变;
(2)根据分析可知,先验证水,若先验证二氧化碳则从溶液中出来的气体无法验证原混合气体中是否有水,则连接顺序为:EC;B中观察到的现象为:绿色晶体变成绿色粉末;
(3)缓缓通入空气,目的为使B装置中残存的水和二氧化碳完全被吸收,答案为:防止水蒸气和二氧化碳的质量测量产生误差;
(4)若缺少装置A,则空气中的水和二氧化碳被吸收,导致计算二氧化碳和水的量比实际偏大,而镍的质量偏小,答案为;偏小;
(5)装置F、第一个D中的质量两次称量的数据相等时可判断碱式碳酸镍已完全分解,答案为:装置F、装置D(前一个)的质量与前一次测量值相比不变时;
(6)装置F中吸收的为水,增重为水的质量,为1.08g,物质的量为0.06mol;装置D中吸收的为二氧化碳,质量增重为0.44g,物质的量为0.01mol,镍的氧化物的质量为3.77g-1.08g-0.44g=2.25g,物质的量为0.03mol,碱式碳酸镍的化学式为Ni3(OH)4CO3·4H2O;

 综合自测系列答案
综合自测系列答案【题目】在一定条件,向一密闭容器中充入一定量CO2气体,并加入足量铁粉,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知该反应在不同温度下的平衡常数如下:
FeO(s)+CO(g),已知该反应在不同温度下的平衡常数如下:
T/℃ | 1200 | 1100 | 1000 | 900 | 800 |
K | 0.36 | 0.49 | 1.0 | 1.23 | 1.89 |
(1)该反应的化学平衡常数表达式为K=______。
(2)该反应为______(填“吸热”或“放热”)反应。
(3)能判断该反应是否达到化学平衡状态的依据是____。
A.容器中压强不变 B.混合气体中c(CO)不变
C.混合气体的平均相对分子质量不变 D.c(CO2)=c(CO)
(4)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是_____(填序号)。
A.温度 B.铁粉的量(足量)
C.压强 D.CO的量
(5)在900℃下,该反应达到平衡时,CO2的物质的量浓度为2mol·L-1,则此时c(CO)=____ mol·L-1