题目内容
15.根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是( )| A. | 固体氯化钠溶于水 | B. | 氯化氢溶于水 | ||
| C. | 冰经加热变成水蒸气 | D. | 氯化铵受热分解生成氯化氢和氨气 |
分析 化学变化的实质是旧化学键断裂、新化学键形成,发生化学变化时一定有旧化学键断裂、新化学键形成,以此来解答.
解答 解:A.NaCl溶于水,只有离子键的断裂,但没有化学键的形成,不属于化学变化,故A错误;
B.氯化氢溶于水,有共价键的断裂,但没有化学键的形成,不属于化学变化,故B错误;
C.冰经加热变成水蒸气没有化学键的断裂和形成,不属于化学变化,故C错误;
D.氯化铵受热分解生成氯化氢和氨气有旧化学键断裂、新化学键形成,属于化学变化,故D正确.
故选D.
点评 本题考查化学键和化学变化,明确化学反应的判断是分析是解答本题的关键,难度不大.

练习册系列答案
相关题目
6.氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种过渡元素硼氢化物储氢材料.
①基态Ti3+中含有的电子数为19,电子占据的最高能级是3d,该能级具有的原子轨道数为5;
②BH-4中B的杂化方式是sp3杂化.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”);
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如表所示
该氢化物的化学式为MgH2.
(1)Ti(BH4)3是一种过渡元素硼氢化物储氢材料.
①基态Ti3+中含有的电子数为19,电子占据的最高能级是3d,该能级具有的原子轨道数为5;
②BH-4中B的杂化方式是sp3杂化.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”);
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如表所示
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
10.下列说法正确的是( )
| A. | NaOH是离子化合物不含共价键 | B. | CO2分子中含有非极性键 | ||
| C. | 12C、13C、14C是碳的三种核素 | D. | 16O、17O、18O含有相同的中子数 |
7.苯和甲苯相比较,下列叙述中不正确的是( )
| A. | 都属于芳香烃 | B. | 都能使KMnO4酸性溶液褪色 | ||
| C. | 都能发生取代反应 | D. | 都能发生加成反应 |
4.石油、煤加工是各种脂肪烃的重要来源,下列判断正确的是( )
| A. | 石油常压蒸馏得到的汽油属于纯净物 | |
| B. | 石油减压蒸馏、煤的液化和气化都是化学变化 | |
| C. | 石油催化裂化的目的是获得更多甲烷 | |
| D. | 石油催化裂化的产物能使溴水和酸性KMnO4溶液褪色 |
14.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 原子半径:X<W | C. | 热稳定性:H2Y>HZ | D. | 还原性:Y2->Z- |
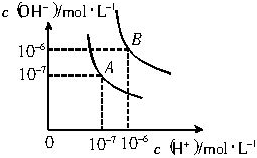 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.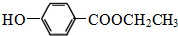
 .
.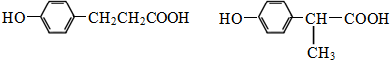 .
.