题目内容
9.下列关于物质性质的叙述中,正确的是( )| A. | 硫是一种淡黄色的难溶于水的晶体,既有氧化性又有还原性 | |
| B. | NO2溶于水生成硝酸,所以NO2是酸性氧化物 | |
| C. | Cl2能在常温下与金属活动性顺序表中大多数金属反应 | |
| D. | 硅是应用广泛的半导体材料,常温下化学性质不活泼,在自然界中有游离态存在 |
分析 A.硫单质不溶于水,化合价处于中间价态,既能够被氧化也能够被还原;
B.二氧化氮溶于水生成硝酸和NO,不属于酸性氧化物;
C.氯气化学性质活泼,能和大多数金属反应;
D.硅属于半导体材料,常温下化学性质不活泼,但是在自然界中以化合态存在.
解答 解:A.硫单质不溶于水,微溶于酒精,易溶于二硫化碳,化合价居于中间价,既有氧化性又有还原性,故A正确;
B.酸性氧化物溶于水生成酸,与碱反应生成盐和水,而二氧化氮与水反应生成硝酸和NO,二氧化氮与氢氧化钠溶液的反应为:2NO2+2NaOH═NaNO2+NaNO3+H2O,该反应中有化合价变化,不属于复分解反应,所以二氧化氮不属于酸性氧化物,故B错误;
C.氯气化学性质活泼,能和大多数金属反应,故C正确;
D.硅属于半导体材料,常温下化学性质不活泼,在自然界中,没游离态的硅,只有以化合态存在的硅,如二氧化硅、硅酸盐等,故D错误;
故选AC.
点评 本题考查了常见元素及其化合物性质、酸性氧化物的判断等知识,题目难度中等,注意掌握常见元素单质及其化合物性质,B为易错点,需要明确二氧化氮不是酸性氧化物.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | NaOH是离子化合物不含共价键 | B. | CO2分子中含有非极性键 | ||
| C. | 12C、13C、14C是碳的三种核素 | D. | 16O、17O、18O含有相同的中子数 |
11.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 相同条件下,NA个CO2分子和NA个H2O分子的体积一定相同 | |
| B. | 含NA个Na+的Na2O溶解于1L水中Na+的物质的量浓度为1mol/L | |
| C. | 电解58.5g熔融的NaCl能产生22.4L氯气(标准状况)和23.0g金属钠 | |
| D. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子书为0.1NA |
8.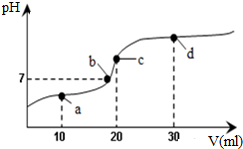 常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )
常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )
 常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )
常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )| A. | a点:c(CH3COO-)>c(Ba2+)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | a至d点过程中:c(Ba2+)一定大于c(OH-) | |
| C. | c点:c(CH3COOH)+c(H+)=c(OH-) | |
| D. | d点:c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+) |
14.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 原子半径:X<W | C. | 热稳定性:H2Y>HZ | D. | 还原性:Y2->Z- |
1. 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )
 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )| A. | 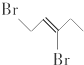 | B. | 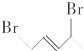 | C. |  | D. | 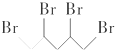 |
18.某有机物其结构如图所示,下列说法中正确的是( )
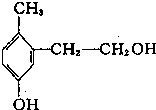

| A. | 它是苯酚的同系物 | |
| B. | 1mol有机物能与2molNaOH反应 | |
| C. | 1 mol该有机物能与金属钠反应产生O.5molH2 | |
| D. | 1 mol该有机物能与溴水反应消耗2 mol Br2发生取代反应 |
19.下列“油”中属于酯类的是( )
①豆油 ②酱油 ③牛油 ④甘油 ⑤重油 ⑥硝化甘油.
①豆油 ②酱油 ③牛油 ④甘油 ⑤重油 ⑥硝化甘油.
| A. | ①③⑥ | B. | ②④⑤ | C. | ①③④ | D. | ③⑤⑥ |
