题目内容
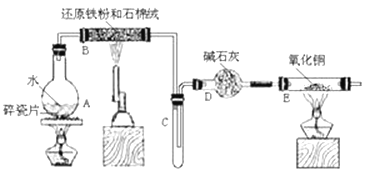
【题目】下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D、E为无色气体,C能使湿润的红色石蕊试纸变蓝,B常温下为无色液体,Fe遇浓的G溶液钝化。

(1)写出下列各物质的化学式:
B:____________;F:____________;G:___________。
(2)写出下列变化的反应方程式:
A→D:________________________________________;
G→E:________________________________________。
(3)实验室里,常用加热_____________________的混合物的方法制取气体C,常采用____________法来收集。
【答案】H2O NO2 HNO3 2CO2+2Na2O2==2Na2CO3+O2 3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O NH4Cl和Ca(OH)2 向下排空气
【解析】
常温下A、C、D、E为无色气体,C能使湿润的红色石蕊试纸变蓝,则C为NH3;X就是铵盐;气体A能与过氧化钠反应生成气体D,则A为CO2,D为O2.氨气催化氧化生成的气体E是NO,F是NO2, G可以与铜反应产生F,则G为硝酸,F为NO2;无色液体B为H2O,X受热分解生成CO2、NH3、H2O,故X为NH4HCO3或(NH4)2CO3;据此分析。
常温下A、C、D、E为无色气体,C能使湿润的红色石蕊试纸变蓝,则C为NH3;A能与过氧化钠反应生成D,则A为CO2,D为O2.氨气催化氧化生成NO,不同浓度的G可以与铜反应,则G为硝酸,F为NO2;无色液体B为H2O,X受热分解生成CO2、NH3、H2O,故X为NH4HCO3或(NH4)2CO3。
(1)由上述分析可知,B为H2O,F为NO2,G为HNO3;
(2) CO2与Na2O2反应,产生碳酸钠和氧气,所以A→D的反应方程式为:2CO2+2Na2O2 ==2Na2CO3+O2;
稀硝酸与铜反应,产生硝酸铜、一氧化氮和水,所以G→E的反应方程式为:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O;
(3)实验室里通常是用铵盐NH4Cl与碱Ca(OH)2共热制取氨气,实验室制取气体氨气的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+ 2NH3↑+2H2O;氨气极易溶于水,不能用排水法收集;根据其密度比空气小的性质,用向下排空气的方法收集。
CaCl2+ 2NH3↑+2H2O;氨气极易溶于水,不能用排水法收集;根据其密度比空气小的性质,用向下排空气的方法收集。