题目内容
【题目】常温下,用0.1000mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程溶液pH随NaOH溶液的体积的变化曲线如图所示(忽略中和热效应)。下列说法不正确的是

A. 常温下,HA的电离常数K(HA)约为10-5
B. v1<20
C. 溶液中水的电离程度:a点>b点
D. 滴定过程为了确定滴定终点,最合适的指示剂是酚酞
【答案】C
【解析】A.常温下,0.1000mol/L的HA溶液pH=3,则HA为弱酸,HA的电离常数K(HA)约为![]() =10-5,故A正确;B.酸碱完全中和时所需NaOH的体积为20mL,此时生成NaA溶液,因水解溶液显碱性,则pH=7时,所需要NaOH的体积v1<20mL,故B正确;C.a点时加入NaOH较少,溶液中c(H+)较大,c(H+)越大,水的电离程度越小,则有水电离出的氢离子浓度:a<b,故C错误;D.完全中和时溶液显碱性,则滴定过程为了确定滴定终点,最合适的指示剂是酚酞,故D正确;答案为C。
=10-5,故A正确;B.酸碱完全中和时所需NaOH的体积为20mL,此时生成NaA溶液,因水解溶液显碱性,则pH=7时,所需要NaOH的体积v1<20mL,故B正确;C.a点时加入NaOH较少,溶液中c(H+)较大,c(H+)越大,水的电离程度越小,则有水电离出的氢离子浓度:a<b,故C错误;D.完全中和时溶液显碱性,则滴定过程为了确定滴定终点,最合适的指示剂是酚酞,故D正确;答案为C。

练习册系列答案
相关题目
【题目】根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
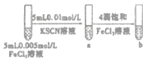
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
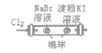
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D