题目内容
【题目】298K时,二元弱酸H2X溶液中含X微粒的分布分数如图所示。下列叙述正确的是
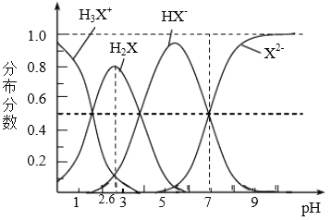
A. 溶液pH由l升至2.6时主要存在的反应是:H3X++OH-=H2X+H20
B. H2X的第二步电离平衡常数Ka2(H2X)为10-4
C. NaHX溶液中c(H+)<c(OH-)
D. 当溶液呈中性时:c(Na+)=2c(X2-)
【答案】A
【解析】
A、溶液pH由1至2.6时,从图中可以判断主要是将H3X+转化为H2X,即反应为H3X++OH-=H2X+H20,A正确;
B、溶液显中性,pH=7的时候,溶液中的HX-和X2-相等,所以![]() ,B错误;
,B错误;
C、从图中可以判断当HA-占主导的时候,溶液显酸性,所以NaHX溶液显酸性,即c(H+)>c(OH-),C错误;
D、溶液显中性,pH=7的时候,溶液中的HX-和X2-相等,存在的电荷守恒为c(Na+)+c(H+)=2c(X2-)+c(HX-)+c(OH-),因为溶液显中性有c(H+)=c(OH-),所以得到c(Na+)=2c(X2-)+c(HX-),D错误。
答案选A。

【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)![]() 4NO2(g)+ O2(g) ΔH>0
4NO2(g)+ O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1