题目内容
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验。(图中夹持及尾气处理装置均已略去)
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_________________________________。
装置B中发生反应的化学方程式是___________________________________。
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行________________________, 装置E中的现象是_____________________________________________________。
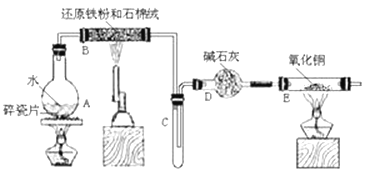
【答案】防止暴沸 3Fe+4H2O(g) ![]() Fe3O4+4H2 验纯 黑色固体变红,玻璃管E右侧内壁有水珠出现
Fe3O4+4H2 验纯 黑色固体变红,玻璃管E右侧内壁有水珠出现
【解析】
(1)加热液体时可能会发生剧烈沸腾现象,加入碎瓷片可防止暴沸;B中Fe与水蒸气反应生成四氧化三铁和氢气;
(2)氢气具有可燃性,若不纯氢气点燃时可能发生爆炸;H2具有还原性,H2与灼热的CuO发生氧化还原反应,生成Cu、水。根据产物的状态、颜色分析。
(1)烧瓶中碎瓷片的作用是防止暴沸,装置B中发生反应的化学方程式是3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)铁与水蒸气反应产生氢气,氢气是可燃性气体,若氢气不纯点燃时可能发生爆炸,所以如果要在C处玻璃管处点燃该气体,则必须对该气体进行验纯;在E中氢气还原CuO生成Cu、水,反应方程式是:H2+CuO![]() Cu+H2O,反应前CuO是黑色固体,反应后变为红色的Cu单质;反应产生的水在玻璃管末端遇冷变为液态水,因此观察到现象是:固体由黑色逐渐变红色,在玻璃管E右侧内壁有水珠出现。
Cu+H2O,反应前CuO是黑色固体,反应后变为红色的Cu单质;反应产生的水在玻璃管末端遇冷变为液态水,因此观察到现象是:固体由黑色逐渐变红色,在玻璃管E右侧内壁有水珠出现。

【题目】一定温度下,10ml 0.40mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6min的平均反应速率: v(H2O2)≈3.3×10-2mol/(L·min)
B. 6~10min的平均反应速率: v(H2O2)<3.3×10-2mol/(L·min)
C. 反应至6min时, c(H2O2)=0.30mol·L-1
D. 反应至6min时,H2O2分解了50%
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)![]() 4NO2(g)+ O2(g) ΔH>0
4NO2(g)+ O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
【题目】下列各组物质之间不能通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| SiO2 | Na2SiO3 | Si | H2SiO3 |
B | Na2O | Na2O2 | Na | NaOH | |
C | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
D | FeCl2 | FeCl3 | Fe | CuCl2 |
A. A B. B C. C D. D