题目内容
【题目】用36.5%、密度为1.19g/cm3的浓盐酸配制0.1mol/L的稀盐酸500mL,请回答:
(1)用量筒量取所需浓盐酸的体积为___mL。
(2)实验配制稀盐酸,所用到的玻璃仪器:___、___、___、___、量筒。
(3)如果在配制过程中,第一次加水量太少,搅拌时间较长,导致配制溶液的浓度___(偏大,偏小或不影响)
【答案】4.2 500mL容量瓶 烧杯 玻璃棒 胶头滴管 偏小
【解析】
(1)根据c=![]() 计算出需要浓盐酸的浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓盐酸体积;
计算出需要浓盐酸的浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓盐酸体积;
(2)依据配制步骤选择需要的仪器;
(3)分析操作对物质的量和溶液体积的影响,依据c=![]() 进行误差分析。
进行误差分析。
(1)质量分数为36.5%、密度为1.19g/cm3的浓盐酸,物质的量浓度c=![]() mol/L=11.9mol/L,设需要浓盐酸体积为V,则依据溶液稀释规律得:0.1mol/L ×500mL=11.9mol/L×V,解得V=4.2mL;
mol/L=11.9mol/L,设需要浓盐酸体积为V,则依据溶液稀释规律得:0.1mol/L ×500mL=11.9mol/L×V,解得V=4.2mL;
(2)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,用到的仪器有:量筒、烧杯、玻璃棒、容量瓶、胶头滴管等,配制500mL0.1mol/L的稀盐酸溶液,应选择500mL容量瓶,所以还缺少的仪器:500mL容量瓶、烧杯、玻璃棒胶头滴管;
(3)如果在配制过程中,第一次加水量太少,搅拌时间较长,会导致溶质HCl挥发,最终导致配制溶液的浓度偏小。

【题目】对于如下反应,其反应过程的能量变化示意图如图:
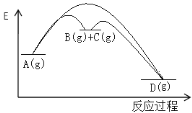
编号 | 反应 | 平衡常数 | 反应热 |
反应① | A(g) | K1 | △H1 |
反应② | B(g)+C(g) | K2 | △H2 |
反应③ | A(g) | K3 | △H3 |
下列说法正确的是
A.K3 =K1 + K2
B. ΔH3=ΔH1 +ΔH2
C.加催化剂,反应①的反应热降低,反应速率加快
D.则增大压强,K1减小,K2增大,K3不变