题目内容
5.下列各组性质比较中,正确的是( )①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F2>Cl2>S ④还原性:Cl-<S2- ⑤气态氢化物稳定性:HF>HCl>H2S.
| A. | ①②③ | B. | ②③④ | C. | ①②④⑤ | D. | ①②③④⑤ |
分析 :①Cl、Br、I位于同一主族,同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物的水化物的酸性逐渐减弱;②同主族元素的金属性从上到下逐渐增强,对应的最高价氧化物的水化物的进行逐渐减弱;③非金属性越强,则单质的氧化性越强;④氧化性越强,对应离子的还原性越弱;⑤同主族元素从上到下元素的非金属性逐渐减弱,同周期元素从左到右非金属性逐渐增强,且非金属性越强,对应的氢化物越稳定.
解答 解:①Cl、Br、I位于同一主族,同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物的水化物的酸性逐渐减弱,所以酸性:HClO4>HBrO4>HIO4,故①正确;
②同主族元素的金属性从上到下逐渐增强,对应的最高价氧化物的水化物的进行逐渐减弱,所以碱性:Ba(OH)2>Mg(OH)2>Be(OH)2,故②正确;
③已知非金属性F>Cl>S,则单质的氧化性F2>Cl2>S,故③正确;
④氧化性越强,对应离子的还原性越弱,氧化性:Cl2>S,所以还原性:Cl-<S2-故④正确;
⑤同主族元素从上到下元素的非金属性逐渐减弱,同周期元素从左到右非金属性逐渐增强,已知非金属性:F>Cl>S,且非金属性越强,对应的氢化物越稳定,则有稳定性:HF>HCl>H2S,故⑤正确.
故选D.
点评 本题考查元素周期表的递变规律,题目难度不大,注意单质、化合物的性质与金属性、非金属性的关系.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
15.在CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O的平衡体系中,加入一定量的C2H518OH,当重新达到平衡时,18O原子应存在于( )
| A. | 乙酸乙酯中 | B. | 乙酸中 | ||
| C. | 水中 | D. | 乙酸、乙酸乙酯和水中 |
16.关于如图所示的原电池,下列说法正确的是( )


| A. | 电子从锌电极通过电流表流向铜电极 | |
| B. | 盐桥中的阴离子向硫酸铜溶液中迁移 | |
| C. | 取出盐桥后,电流计的指针仍发生偏转 | |
| D. | 铜电极上发生的电极反应是2H++2e-═H2↑ |
13.在给定条件下,下列加线的物质在化学反应中几乎能被完全消耗的是( )
| A. | 8.7 g二氧化锰与50 mL8 mol•L-1浓盐酸共热制取氯气 | |
| B. | 19.2 g铜与100 mL12 mol•L-1的硝酸反应 | |
| C. | 常温下,将5.4 g铝片投入20 mL18 mol•L-1的硫酸中 | |
| D. | 将足量的Cu置于50 mL18 mol•L-1H2SO4溶液中加热 |
20.烧碱在生产中有广泛的应用,烧碱是指( )
| A. | 碳酸钠 | B. | 氢氧化钠 | C. | 碳酸氢钠 | D. | 氯化钠 |
14.碳酸钠溶液中存在着Na2CO3+H2O?NaHCO3+NaOH的平衡,加热蒸干溶液,得到的固体是( )
| A. | Na2CO3 | B. | NaHCO3和NaOH | C. | NaOH | D. | Na2CO3和NaOH |
12.下列各物质中,不属于高分子化合物但能发生水解反应的是( )
| A. | 纤维素 | B. | 油脂 | C. | 葡萄糖 | D. | 酶 |
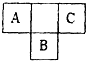 A、B、C为短周期元素,在周期表中所处位置如图所示.A、C两原子的核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处位置如图所示.A、C两原子的核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等. ,C单质的电子式是
,C单质的电子式是 .
.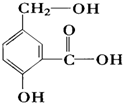 某有机物A的结构简式如图.
某有机物A的结构简式如图.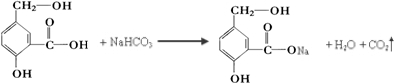 .
.