题目内容
13.在给定条件下,下列加线的物质在化学反应中几乎能被完全消耗的是( )| A. | 8.7 g二氧化锰与50 mL8 mol•L-1浓盐酸共热制取氯气 | |
| B. | 19.2 g铜与100 mL12 mol•L-1的硝酸反应 | |
| C. | 常温下,将5.4 g铝片投入20 mL18 mol•L-1的硫酸中 | |
| D. | 将足量的Cu置于50 mL18 mol•L-1H2SO4溶液中加热 |
分析 A.在加热条件下,二氧化锰和浓盐酸反应生成氯气,但和稀盐酸不反应;
B.Cu和浓硝酸反应生成二氧化氮、和稀硝酸反应生成NO;
C.常温下,Al和浓硫酸发生钝化现象;
D.加热条件下,浓硫酸和Cu反应生成二氧化硫,稀硫酸和Cu不反应.
解答 解:A.浓盐酸和二氧化锰反应,稀盐酸和二氧化锰不反应,随着反应的进行,浓盐酸会变成稀盐酸,所以8.7g二氧化锰和50mL8mol•L-1浓盐酸不能完全反应,故A错误;
B.19.2g铜为0.3mol,与硝酸发生:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O,硝酸的物质的量为1.2mol,铜可完全反应,故B正确;
C.常温下,铝与浓硫酸发生钝化反应,铝不能溶解,故C错误;
D.随着反应的进行,硫酸的浓度逐渐降低,稀硫酸与铜不反应,故D错误.
故选B.
点评 本题考查元素化合物性质,明确物质之间的反应是解本题关键,有些化学反应受温度、浓度、物质的量的影响,注意:二氧化锰和稀盐酸不反应、Cu和稀硫酸及稀盐酸不反应,为易错点.

练习册系列答案
相关题目
6.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 使酚酞试液变红的溶液中:S2-、SO42-、SO32-、Na+ | |
| B. | 由水电离出的c(H+)=10-12mol/L的溶液中:Na+、HCO3-、SO42-、K+ | |
| C. | pH=0的溶液中:Na+、K+、Fe2+、NO3- | |
| D. | pH=7的溶液中:Al3+、Cl-、SO42-、CO42- |
4.某有机物A的结构为Br-CH2-CH=CH-CH2OH,它不可能发生的反应是( )
| A. | 与硝酸银溶液反应生成AgBr | B. | 使溴的四氯化碳溶液褪色 | ||
| C. | 与金属钠反应放出氢气 | D. | 使高锰酸钾溶液褪色 |
1.将新制的氯水滴入下列溶液中,不发生反应的是( )
| A. | 碘化钠 | B. | 硫酸铁 | C. | 硝酸银 | D. | 氢氧化钾 |
18.下列措施不符合节能减排的是( )
| A. | 大力发展火力发电,解决电力紧张问题 | |
| B. | 在屋顶安装太阳能热水器为居民提供生活用热水 | |
| C. | 用石灰对煤燃烧后形成的烟气脱硫,并将炉渣制成建筑材料 | |
| D. | 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气 |
5.下列各组性质比较中,正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F2>Cl2>S ④还原性:Cl-<S2- ⑤气态氢化物稳定性:HF>HCl>H2S.
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F2>Cl2>S ④还原性:Cl-<S2- ⑤气态氢化物稳定性:HF>HCl>H2S.
| A. | ①②③ | B. | ②③④ | C. | ①②④⑤ | D. | ①②③④⑤ |
20.CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g).在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温.实验测得相关数据如图1和图2.
下列有关说法正确的是( )
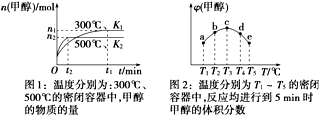
下列有关说法正确的是( )

| A. | 该反应的正反应是气体体积减小的吸热反应 | |
| B. | K1<K2(K为该条件下反应的平衡常数) | |
| C. | 反应进行到5 min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动 | |
| D. | 将容器c中的平衡状态时的甲醇体积分数转变到容器d中的平衡状态的甲醇体积分数,可采取的措施有升温或减压 |