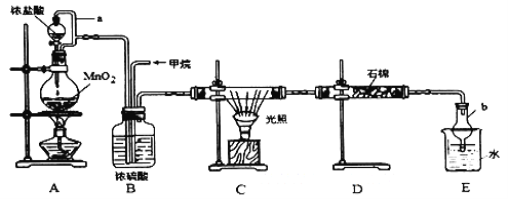
��Ŀ����
����Ŀ��ij�¶��£���4.0 L�����ܱ������г���2.0 mol PCl5����ӦPCl5(g) ��PCl3(g)��Cl2(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
ʱ��/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
����˵����ȷ����
A����Ӧ��ǰ50 s��ƽ������Ϊv(PCl3)��0.0064 mol/(L��s)
B�������������������䣬�����¶ȣ�ƽ��ʱc(PCl3)��0.11 mol��L��1������Ӧ�ġ�H��0
C����ͬ�¶��£���ʼʱ��������г��� 4.0 mol PCl3��4.0 mol Cl2���ﵽƽ��ʱ��PCl3��ת����С�� 80%
D����ͬ�¶��£���ʼʱ��������г���2.0 mol PCl5��0.40 mol PCl3��0.40 mol Cl2���ﵽƽ��ǰv(��)��v(��)
���𰸡�D
��������
���������A���ɱ������ݿ�֪50s�ڣ���n(PCl3)=0.32mol��v(PCl3)= 0.0016 mol/(L��s)����A����B���ɱ������ݿ�֪��ƽ��ʱn(PCl3)=0.4mol�����������������䣬�����¶ȣ�ƽ��ʱ��c(PCl3)=0.11 mol/L����n��(PCl3)=0.11 mol/L��4L=0.44mol��˵�������¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ������H��0����B����C��ԭƽ��ʱPCl5ת����Ϊ20%����ЧΪ2.0 mol PCl3��2.0 mol Cl2����ʱPCl3��ת����Ϊ80%��������ʼʱ���� 4.0 mol PCl3��4.0 mol Cl2����ԭƽ����ȣ�ѹǿ����ƽ�����淴Ӧ�����ƶ���ƽ��ʱ��PCl3ת���ʸ���80%����C����
D�����ڿ��淴Ӧ�� PCl5(g)![]() PCl3(g) + Cl2(g)��
PCl3(g) + Cl2(g)��
��ʼ��mol/L����0.5 0 0
�仯��mol/L����0.1 0.1 0.1
ƽ�⣨mol/L����0.4 0.1 0.1
����ƽ�ⳣ��k=![]() =0.025��
=0.025��
��ʼʱ�������г���2.0 mol PCl5��0.40 molPCl3��0.40 molCl2����ʼʱPCl5��Ũ��Ϊ0.5mol/L��PCl3��Ũ��Ϊ0.1mol/L��Cl2��Ũ��Ϊ0.1mol/L��Ũ����Qc=![]() =0.02��K��Qc��˵��ƽ��������Ӧ�����ƶ�����Ӧ��ƽ��ǰv��������v���棩����D��ȷ����ѡD��
=0.02��K��Qc��˵��ƽ��������Ӧ�����ƶ�����Ӧ��ƽ��ǰv��������v���棩����D��ȷ����ѡD��