题目内容
【题目】下列解释事实的反应方程式不正确的是( )
A. 向碳酸钠溶液中滴加酚酞溶液,溶液变红:CO32-+2H2O![]() H2CO3+ 2OH-
H2CO3+ 2OH-
B. 以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2+ + S2-===CuS↓
C. 向AgCl沉淀中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-![]() Ag2S+2Cl-
Ag2S+2Cl-
D. 向KI溶液中滴加稀硫酸和淀粉溶液,放置在空气中溶液变蓝:4H++4I-+O2=== 2I2 + 2H2O
【答案】A
【解析】
A、纯碱溶液中滴加酚酞溶液显红色是因为碳酸根离子水解生成碳酸氢根离子和氢氧根离子,离子方程式:CO32-+H2O![]() HCO3-+ OH-,故A错误;
HCO3-+ OH-,故A错误;
B、以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2+ + S2-===CuS↓,故B正确;
C、 向AgCl沉淀中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-![]() Ag2S+2Cl-,故C正确;
Ag2S+2Cl-,故C正确;
D、向KI溶液中滴加稀硫酸和淀粉溶液,放置在空气中溶液变蓝:4H++4I-+O2=== 2I2 + 2H2O,故D正确;
本题选A

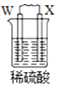
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.四种金属的活动性强弱顺序为Z>W>Y>X
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置甲中X作原电池正极
D.装置丙中溶液的c(H+)减小
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
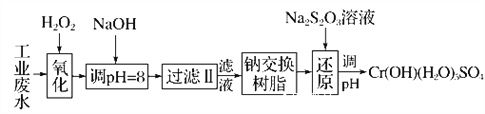
注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
(1)氧化过程中可代替H2O2加入的试剂是________(填字母,下同)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;
已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是____________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O![]() 的废水,该法用Fe作电极电解含Cr2O
的废水,该法用Fe作电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是_____________。
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-20,假设溶液的c(Cr3+)=0.01mol/L,当pH应为______时开始生成沉淀。