题目内容
19. 随着我国工业化水平的不断发展,研究空气污染、废水处理等问题成为重要课题.
随着我国工业化水平的不断发展,研究空气污染、废水处理等问题成为重要课题.(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图所示:
①SCR技术中的氧化剂为NO、NO2
②当NO2与NO的物质的量之比为1:l时,与足量氨气在一定条件下发生反应.该反应的化学方程式为2NH3+NO+NO2=2N2+3H2O.当有3mol电子发生转移时,则参与反应的NO的物质的量为0.5mol.
(2)电镀废水中常含有毒的NaCN、HCN等.NaCN水溶液显碱性的原因是CN-+H2O?HCN+OH-(用离子方程式表示);HCN的Ka=6.17×10-10,用NaOH溶液调节含CN-的废水至pH=9,此时废水中c(CN-)<c(HCN)(填“>”、“<”或“=”).
(3)室温下有如下数据:草酸(H2C2O4)的K1=5.4×10-2,K2=5.4×10-5;醋酸的K=1.75×10-5;碳酸的K1=4.2×10-7,K2=4.5×10-11;Ksp(CaC2O4)=5.0×10-9;Ksp(CaCO3)=2.5×10-9
①用醋酸溶液鉴别CaC2O4和CaCO3两种白色固体的实验现象是一种固体溶解同时产生气泡逸出,另一种固体无现象;
②向0.6mol•L-1的NaCO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:CO32-(aq)+CaC2O4 (s)?CaCO3(s)+C2O42-(aq),静置后沉淀转化达到平衡,此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应)为0.4 mol•L?1.
分析 (1)①得电子,化合价降低的反应物是氧化剂;
②根据化合价升降总数相等、原子守恒来配平;
(2)HCN为弱酸,NaCN溶液水解溶液显显碱性;HCN的Ka=6.17×10-10,根据其水解方程式CN-+H2O?HCN+OH-,得水解平衡常数Kh=$\frac{{K}_{w}}{{K}_{a}}$计算;
(3))①醋酸的酸性大于碳酸的酸性,小于草酸的酸性,故醋酸与CaC2O4不反应,与CaCO3反应有气泡逸出;
②该反应的K=$\frac{c({C}_{2}{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c({C}_{2}{{O}_{4}}^{2-})•c(C{a}^{2+})}{c(C{{O}_{3}}^{2-})•c(C{a}^{2+})}$=$\frac{Ksp(Ca{C}_{2}{O}_{4})}{Ksp(CaC{O}_{3})}$=$\frac{5.0×1{0}^{-9}}{2.5×1{0}^{-9}}$=2.0,设c(CO32-)转化了x,则生成c(C2O42-)=x,剩余c(CO32-)=(0.6-x),
结合K的表达式计算.
解答 解:(1)①由图甲可知SCR技术中NH3与NO、NO2反应产物为N2和水,故氧化剂为NO、NO2,故答案为:NO、NO2;
②NH3中氮的化合价由-3价升高到0价,一个NH3失去3个电子,NO2中氮的化合价由+4价降低到0价,一个NO2得到4个电子,NO中氮的化合价由+2价降低到0价,一个NO得到2个电子,当NO2与NO的物质的量之比为1:1时,转移电子的最小公倍数为6,结合质量守恒可知方程式为:2NH3+NO+NO2=2N2+3H2O;每有1molNO反应转移电子6mol,所以有3mol电子发生转移时,生成NO0.5mol,故答案为:2NH3+NO+NO2=2N2+3H2O;0.5mol;
(2)HCN为弱酸,NaCN溶液水解溶液显显碱性,水解方程式为:CN-+H2O?HCN+OH-,根据其水解方程式CN-+H2O?HCN+OH-,pH=9,则c(OH-)=10-5mol/L,得水解平衡常数Kh=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{1{0}^{-14}}{6.17×1{0}^{-10}}$=$\frac{c(O{H}^{-})c(HCN)}{c(C{N}^{-})}$=$\frac{1{0}^{-5}c(HCN)}{c(C{N}^{-})}$,则$\frac{c(C{N}^{-})}{c(HCN)}$=6.17×10-1,故答案为:CN-+H2O?HCN+OH-;<;
(3)①醋酸的酸性大于碳酸的酸性,小于草酸的酸性,故醋酸与CaC2O4不反应,与CaCO3反应有气泡逸出;
故答案为:一种固体溶解同时产生气泡逸出,另一种固体无现象;
②K=$\frac{c({C}_{2}{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c({C}_{2}{{O}_{4}}^{2-})•c(C{a}^{2+})}{c(C{{O}_{3}}^{2-})•c(C{a}^{2+})}$=$\frac{Ksp(Ca{C}_{2}{O}_{4})}{Ksp(CaC{O}_{3})}$=$\frac{5.0×1{0}^{-9}}{2.5×1{0}^{-9}}$=2.0,
设c(CO32-)转化了x,则生成c(C2O42-)=x,剩余c(CO32-)=(0.6-x),
可得方程:$\frac{x}{0.6-x}$=2.0,解得x=0.4 mol•L?1;
故答案为:0.4 mol•L?1.
点评 本题考查了氧化还原反应中氧化剂和还原剂判断、氧化还原方程式书写、水解平衡常数计算、弱酸的性质等知识,综合性较强,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 浓盐酸、浓硫酸、浓硝酸均具有氧化性,都属于氧化性酸 | |
| B. | Na2O、SO2、BaSO4在熔融状态或溶于水时均能导电,都属于电解质 | |
| C. | NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属于离子化合物 | |
| D. | 金刚石、二氧化硅、碳化硅晶体中原子间均以共价键结合,都属于原子晶体 |
| A. | 氧气 | B. | 二氧化硫 | ||
| C. | 二氧化氮和氧气 | D. | 二氧化氮和一氧化氮 |
MnO4-+H2C2O4+H+--Mn2++CO2↑+H2O(未配平)
用4mL 0.001mol•L-1KMnO4溶液与2mL 0.01mol•L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:回答下列问题:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和X溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(2)如果研究浓度对化学反应速率的影响,应使用实验I和IV(用Ⅰ~Ⅳ表示,下同),实验Ⅳ中加入1mL蒸馏水的目的是确保I和IV组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
(3)如果研究温度对化学反应速率的影响,应使用实验I和III.
(4)研究发现,在反应开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.在排除温度的影响后,你猜想还可能是催化剂(或锰离子的催化作用)的影响.为了验证这种猜想,某同学在实验Ⅱ中加入X溶液进行验证,则X可能是B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
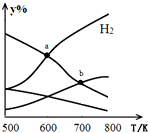 以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )| A. | a点的平衡常数小于b点 | |
| B. | b点,v正(CO2)=v逆(H2O) | |
| C. | a点,H2和H2O物质的量相等 | |
| D. | 其他条件恒定,充入更多H2,v(CO2)不变 |
| A. | 放Na2CO3的一端托盘下沉 | B. | 放NaHCO3的端托盘下沉 | ||
| C. | 仍保持平衡 | D. | 无法判断 |
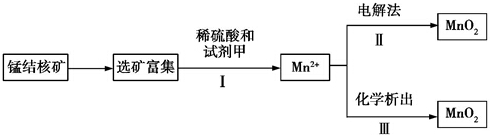
已知:化学析出时用NaClO3作析出试剂,每生成0.05mol MnO2时消耗0.02mol NaClO3.根据以上工艺流程及信息,判断下列说法不正确的是( )
| A. | 步骤Ⅰ中的试剂甲必须具有较强的还原性 | |
| B. | 步骤Ⅲ发生反应的离子方程式为:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+ | |
| C. | 若用电解法,则MnO2将在阳极产生,电极反应式为Mn2+-2e-+2H2O═MnO2+4H+ | |
| D. | 测定步骤Ⅰ所得溶液中Mn2+的含量可采用先将Mn2+转化为Mn,然后再用0.1 mol•L-1HCl标准溶液滴定的方法 |
| A. | 丁烯和丁二烯 | B. | 丙醛和丙酮 | C. | 乙醇和乙醚 | D. | 丙二醇和丙三醇 |